納米酶
摘要
背景:腸道菌群參與了結腸癌的發生發展,一些致病菌如膿桿菌可以促進腫瘤的生長和轉移。腫瘤為致病菌提供生存環境,形成病原體-腫瘤共生關系。破壞這種共生關系可能是腫瘤治療的新靶點。
方法:作者設計合成了一種蛋白質支撐的銅單原子催化劑BSA-Cu SAN,模擬天然酶的結構。該催化劑可以催化過氧化氫生成活性氧(ROS),同時消耗谷胱甘肽(GSH)。
結果:BSA-Cu SAN可以有效殺死腫瘤內的膿桿菌,切斷病原體-腫瘤共生關系;并可通過腎臟排出避免長期毒性。BSA-Cu SAN可以降低膿桿菌誘導的腫瘤細胞自噬水平,減弱其ROS耐受性,從而促進腫瘤細胞凋亡。動物實驗證實BSA-Cu SAN可以抑制腫瘤生長。
結論:破壞病原體-腫瘤共生關系可作為腫瘤治療新策略。蛋白質支撐的銅單原子催化劑為單原子催化劑的設計和臨床轉化提供新思路。

圖文導讀
本文章探討了毀滅腫瘤-病原體共生體的策略來抑制腫瘤。主要內容如下:
1. 腸道菌群對結腸癌的發生發展起關鍵作用,一些致病菌如膿桿菌(F. nucleatum)可以促進腫瘤的生長和轉移。腫瘤微環境為這些致病菌提供了良好的生存環境,形成了病原體-腫瘤共生關系。
2. 作者設計了一種蛋白支撐的銅單原子催化劑(BSA-Cu SAN),具有過氧化物酶樣活性,可以催化H2O2生成ROS,同時消耗GSH。
3. BSA-Cu SAN可以有效地殺死F. nucleatum,切斷病原體-腫瘤共生關系。F. nucleatum引起的腫瘤細胞自噬水平升高和ROS耐受性也會減弱,從而促進腫瘤細胞凋亡。
4. 在體內實驗中,BSA-Cu SAN可以通過腎臟排出,避免了長期系統毒性的擔憂,抑制了腫瘤生長。
5. 本研究證明了毀滅腫瘤-病原體共生體是一種可行的腫瘤治療策略,為進一步開發這方面的療法和藥物奠定了基礎。蛋白支撐的銅單原子催化劑也為單原子催化劑的臨床轉化提供了新思路。
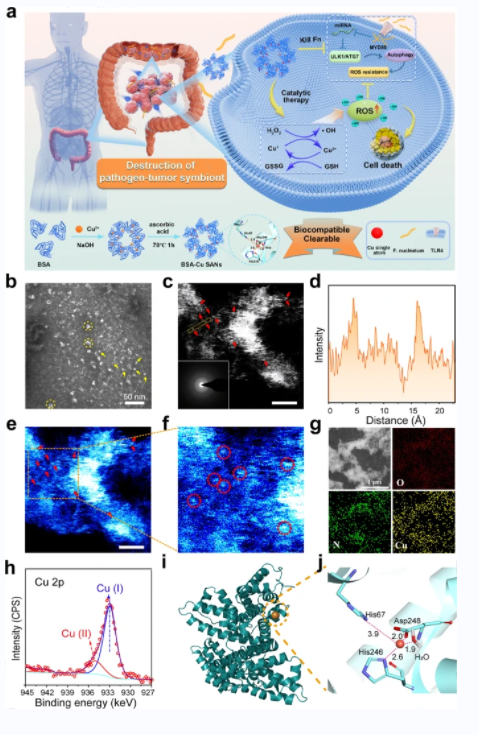
圖一:BSA-Cu SAN的形成和表征。 BSA-Cu SAN的合成及其破壞病原體-腫瘤共生體用于抗腫瘤治療的功能示意圖。
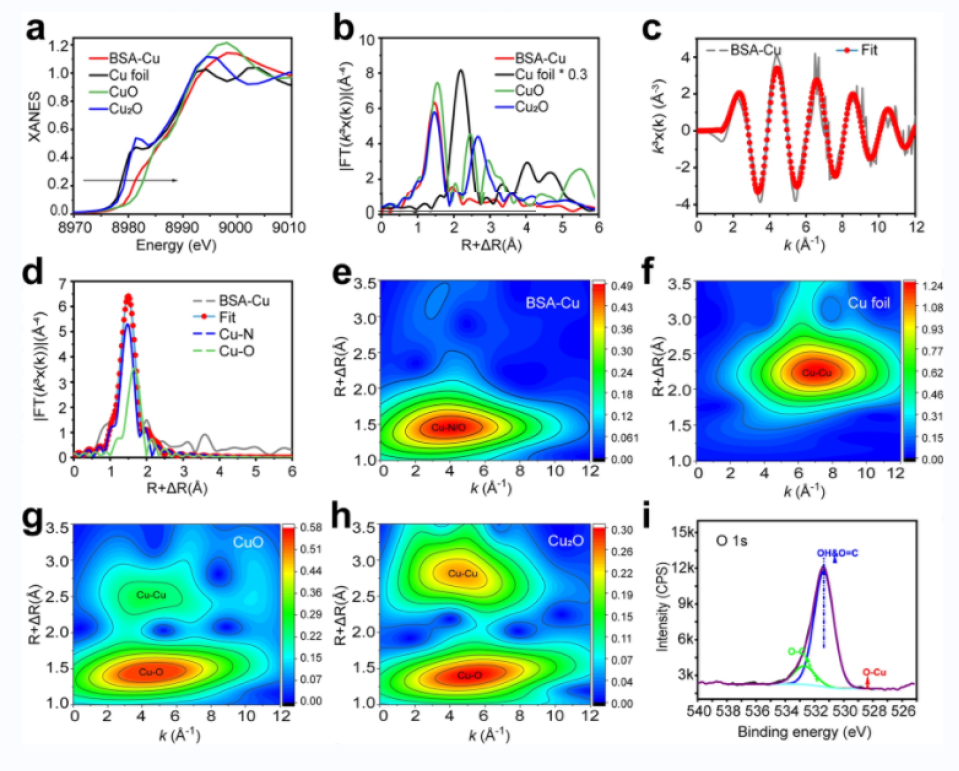
圖二:BSA-Cu SAN的原子結構表征
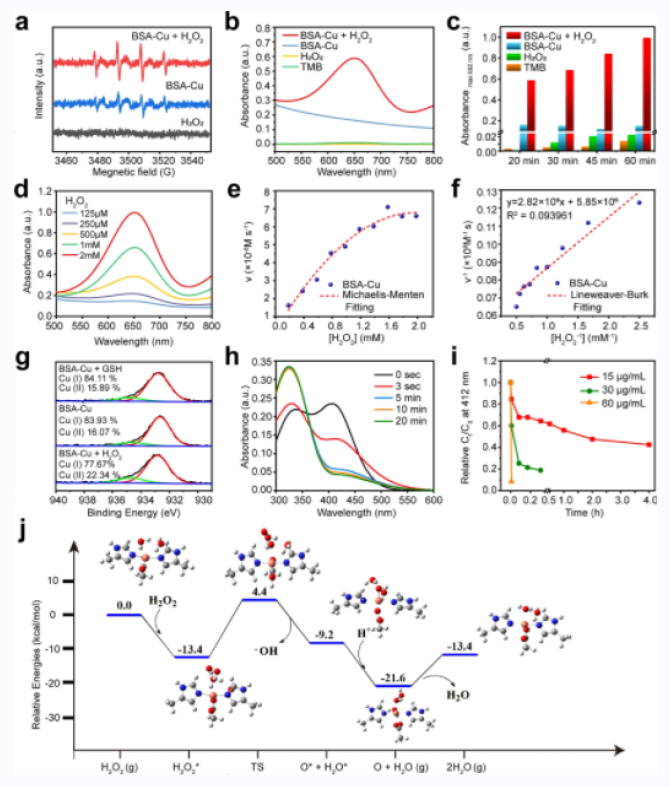
圖三:BSA-Cu SAN的酶樣活性和GSH消耗性能
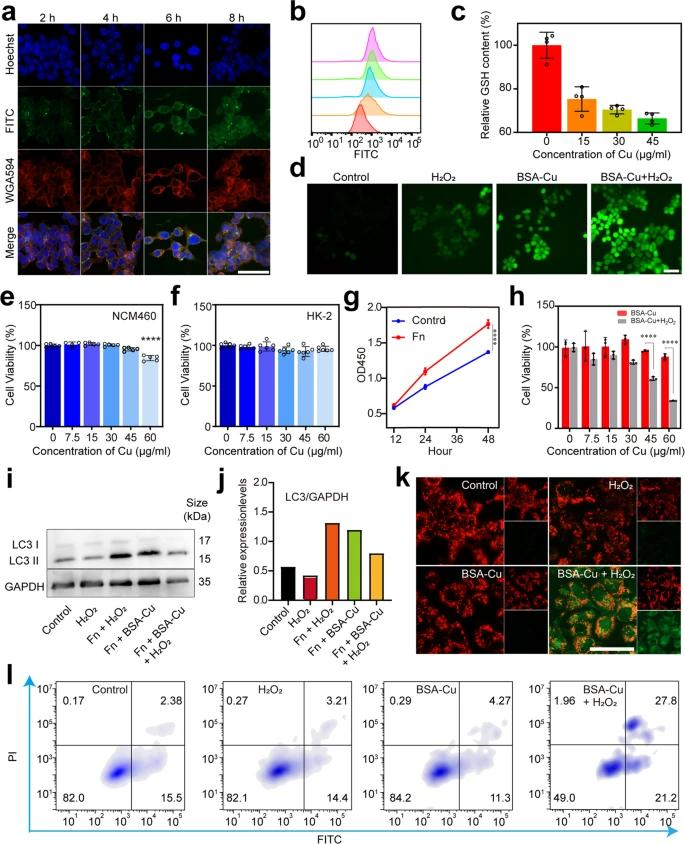
圖四:體外干預 F. nucleatum 誘導的腫瘤增殖與 BSA-Cu SAN 在 HCT116 細胞上。在不同時間與含有116μg/mL銅的BSA-Cu-FITC孵育的HCT45細胞的CLSM圖像。
本文亮點
提出了“毀滅腫瘤-病原體共生體”的治療策略,這一策略充分認識到腫瘤與致病菌之間的互利共生關系,利用消滅腫瘤內致病菌來切斷這種關系,阻斷致病菌促進腫瘤發展的途徑,這是目前腫瘤治療研究的一個新方向。設計合成了蛋白質支撐的銅單原子催化劑BSA-Cu SAN,這是首個以蛋白質為載體的金屬單原子催化劑,模擬了天然酶的結構,即以蛋白質為基質,金屬原子為活性中心。這為單原子催化劑的設計提供了新的思路。BSA-Cu SAN能夠通過催化H2O2生成ROS殺死腫瘤內致病菌,且能通過腎臟排出而避免長期毒性,這為單原子催化劑的臨床轉化提供了可行性驗證。
實驗證明BSA-Cu SAN能減弱腫瘤細胞的自噬水平和ROS耐受性,這可能是通過消滅腫瘤內致病菌實現的,說明可通過調節腫瘤細胞的生理狀態來增強治療效果。在動物模型中驗證了毀滅腫瘤-病原體共生體策略的有效性,為這一策略的臨床轉化提供了支持。全面系統地研究了BSA-Cu SAN的毒性、生物安全性、體內代謝和排泄過程,為其進一步的研發和應用奠定了基礎。
17715390137


