《Science》 頂刊最新發(fā)布:Pt-COF-Apt——用于腫瘤靶向的自增強光催化治療
發(fā)布時間:2023-07-25 16:56:16 人氣:1936
導(dǎo)讀
共價有機框架(COF)已成為納米醫(yī)學(xué)的一個有前景的平臺,但由于缺乏有效的 COF 修飾策略,開發(fā)多功能 COF 納米平臺仍然具有挑戰(zhàn)性。在此,本文提出了一種用于COF功能化的納米酶橋接(NZB)策略。作為過氧化氫酶模擬物的鉑納米顆粒(Pt NPs)原位生長在COF NPs的表面上,而不降低其載藥能力(CP),并且硫醇封端的適體通過穩(wěn)定的Pt-S鍵進一步致密地裝飾到CP NPs上 (CPA)。Pt納米酶工程和適體功能化使納米平臺具有優(yōu)異的光熱轉(zhuǎn)換、腫瘤靶向和過氧化氫酶樣催化性能。使用臨床批準(zhǔn)的光敏劑吲哚菁綠(ICG)作為模型藥物,制造了用于腫瘤靶向自強化治療的納米系統(tǒng)(ICPA)。ICPA能夠有效地積聚到腫瘤組織中,通過分解過度表達的H2O2并產(chǎn)生O2來緩解缺氧微環(huán)境。在單波長近紅外光照射下,ICPA的類過氧化氫酶催化和單線態(tài)氧生成活性顯著增強,從而以自我強化的方式對惡性細胞和荷瘤小鼠產(chǎn)生良好的光催化治療效果。
圖文參考
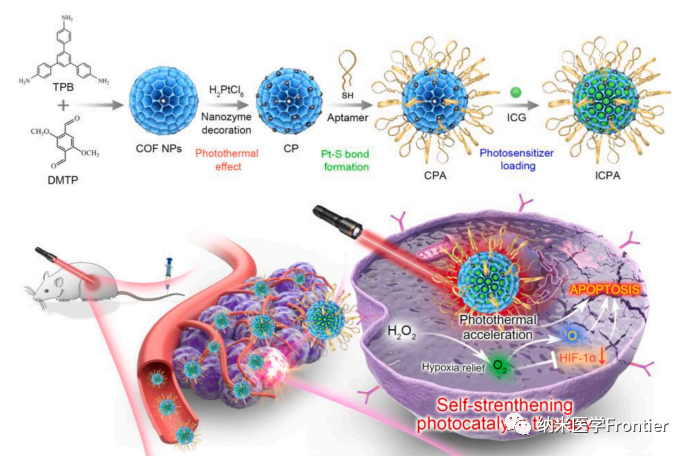
圖1. ICPA的合成及其在單波長近紅外光照射下以自我強化方式逆轉(zhuǎn)腫瘤缺氧、誘導(dǎo)腫瘤熱損傷和氧化應(yīng)激的應(yīng)用
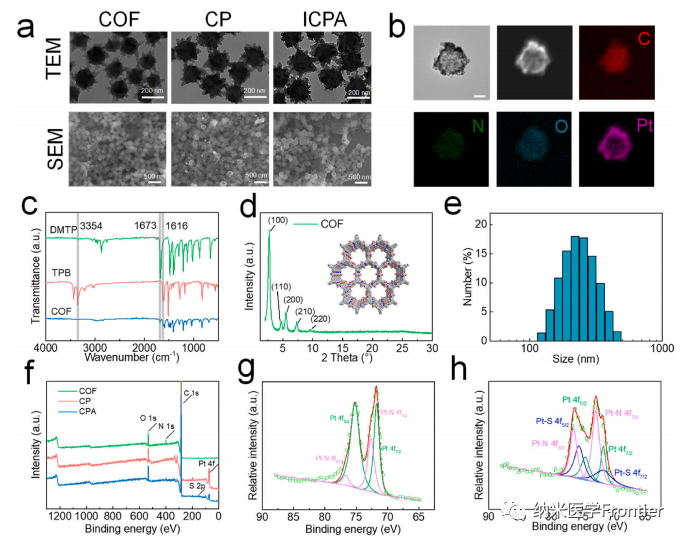
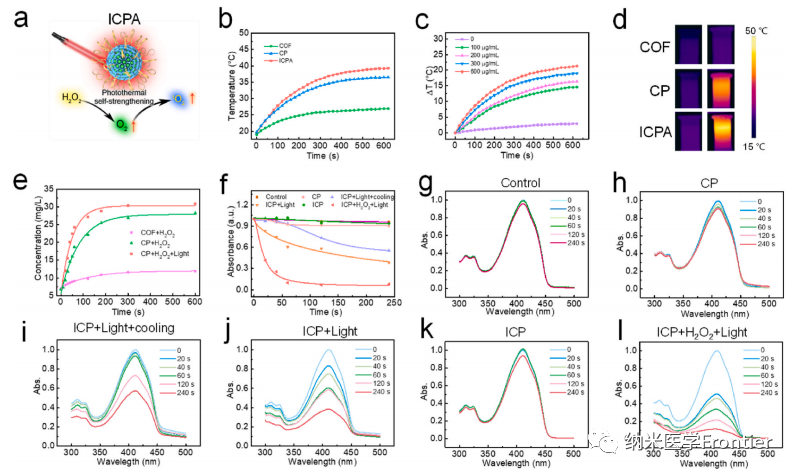
圖3.(a)單波長近紅外輻射下具有自增強方式的ICPA示意圖。(b) 各種納米粒子 (600 μg/mL) 在 808 nm 光照射 (1 W/cm2) 下的光熱曲線和 (d) 光熱圖像。(c) 808 nm激光(1 W/cm2)下不同濃度ICPA的光熱曲線。(e)通過溶氧儀測量不同處理的不同材料的產(chǎn)氧能力。(f)不同納米顆粒引起的DPBF吸收衰減率。(g)–(l)不同處理后DPBF的紫外可見光譜。
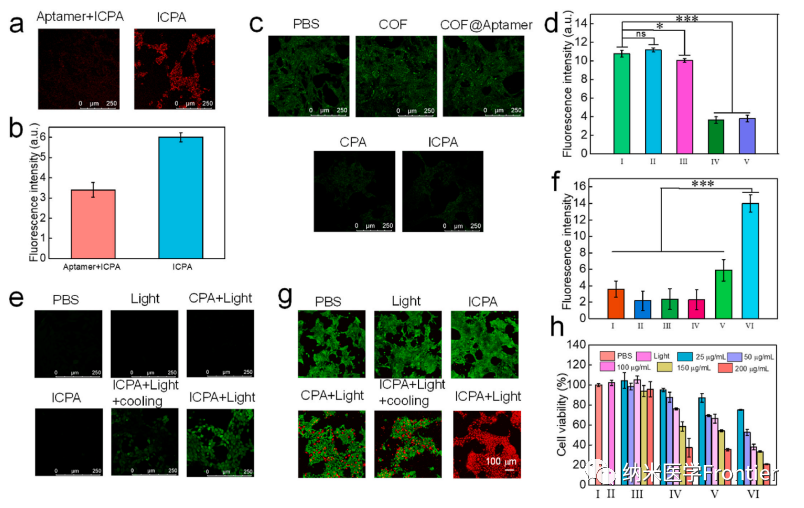
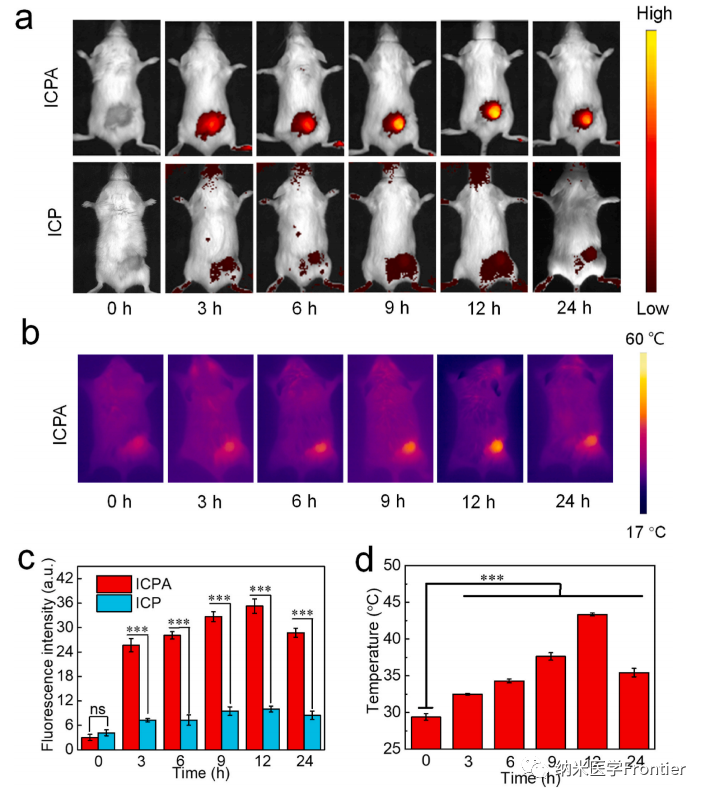
圖5.(a)在不同時間點注射ICPA或ICP的4T1荷瘤小鼠的體內(nèi)熒光成像和(c)(a)中腫瘤區(qū)域熒光強度的量化。(b)靜脈注射ICPA后不同時間點小鼠的熱圖像和(d)(b)的溫度量化。(*p < 0.05,**p < 0.01,***p < 0.001)。
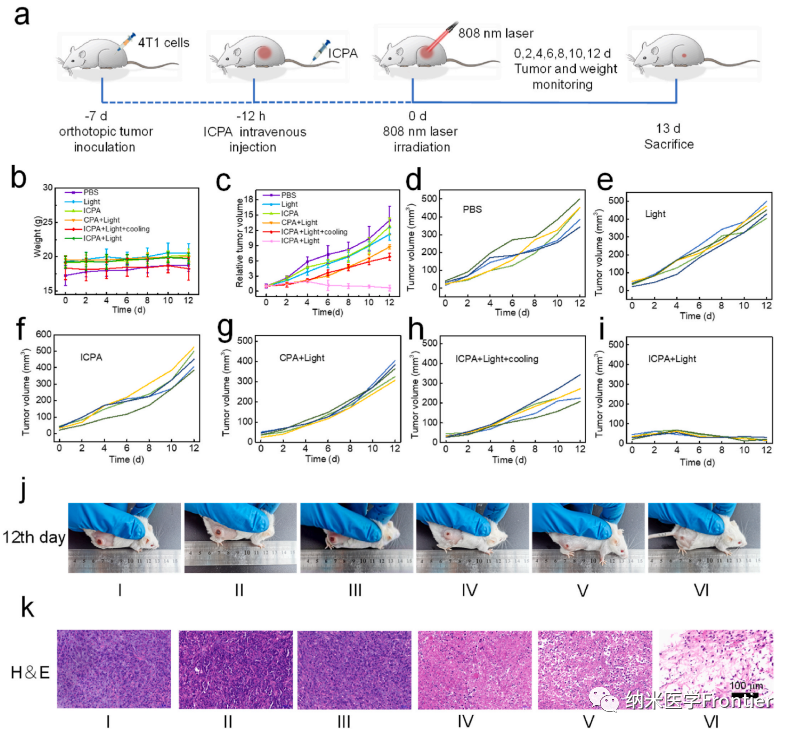
圖6.(a)動物實驗示意圖。(b) 接受不同處理的小鼠12天內(nèi)體重變化曲線。(c)不同組的相對腫瘤體積。(d–i) 不同治療小鼠的腫瘤體積。(j)不同治療后荷瘤小鼠的照片。(k)不同處理后腫瘤切片的H&E染色。(I,PBS;II,光;III,ICPA;IV,CPA + 光;V,ICPA + 光 + 冷卻;VI,ICPA + 光)。
總結(jié):
Pt-COF-Apt納米平臺具有良好的水溶性、穩(wěn)定性、生物相容性和腫瘤靶向能力。在體外實驗中,Pt-COF-Apt納米平臺能夠有效地識別和殺死腫瘤細胞,表現(xiàn)出高效的光催化治療效果。在體內(nèi)實驗中,Pt-COF-Apt納米平臺能夠有效地聚集在腫瘤部位,產(chǎn)生大量的活性氧物種,從而抑制腫瘤的生長和轉(zhuǎn)移。該實驗證明了Pt-COF-Apt納米平臺作為一種新型的光敏劑,為腫瘤靶向的自增強光催化治療提供了一種新的策略。光催化治療是一種利用光敏劑在光照下產(chǎn)生活性氧物種,從而殺死腫瘤細胞的方法。該方法具有無創(chuàng)、高效、低毒性等優(yōu)點,但也存在一些問題,如光敏劑的穩(wěn)定性、選擇性和光催化效率等。
創(chuàng)新點:
1.本研究制備了一種新型的納米材料ICP,具有優(yōu)異的光熱轉(zhuǎn)換能力和抗腫瘤藥物負(fù)載能力,可用于腫瘤靶向的光熱治療。利用鉑納米酶橋接的共價有機框架(Pt-COF)作為光敏劑,與適配體(Apt)結(jié)合,形成Pt-COF-Apt納米平臺。
2. 評估了ICP的光熱轉(zhuǎn)換能力和抗腫瘤藥物負(fù)載能力,發(fā)現(xiàn)其在近紅外光照射下能夠產(chǎn)生較高的溫度,并可以有效地負(fù)載抗腫瘤藥物。3. 評估了ICP的抗腫瘤效果,發(fā)現(xiàn)其在體外和體內(nèi)實驗中都能夠有效地抑制腫瘤生長。
| 溫馨提示:蘇州北科納米供應(yīng)產(chǎn)品僅用于科研,不能用于人體,不同批次產(chǎn)品規(guī)格性能有差異。網(wǎng)站部分文獻案例圖片源自互聯(lián)網(wǎng),圖片僅供參考,請以實物為主,如有侵權(quán)請聯(lián)系我們立即刪除。 |
上一篇: 碳點新突破:清除ROS,生物成像


