Nature:納米顆粒的設計原則,以克服藥物遞送的生物屏障
發布時間:2021-09-22 08:40:49 人氣:1242

一、文章概述
在各種疾病的治療過程中,患者能否被成功治愈依賴于醫生將藥物遞送到特定部位的能力,癌癥是其中的典型例子,經過了一個世紀的發展,如今的治療手段還是無法使藥物集中于藥物的作用部位,藥物分子只是簡單地在全身分布擴散,這容易引起人體不良的副作用并浪費大量藥物。在長期對藥物遞送的研究中,學者發現納米顆粒已成為克服常規藥物制劑及其相關藥代動力學限制的合適載體,如脂質體已被證明在溶解治療藥物方面具有優勢,可以控制藥物長期緩釋,大大延長了藥物的循環壽命。但藥物遞送過程中的生物屏障阻止了納米藥物載體在患病部位的積累,從而限制了藥物治療時的有效反應。盡管大量的研究工作旨在將多種功能納入整個納米顆粒設計,但其中許多策略未能充分解決這些障礙,例如非特異性分布和治療藥物積累不足,這仍然是藥物開發人員面臨的巨大挑戰。除非納米載體的設計能解決顆粒在靜脈給藥時遇到的大部分(如果不是全部)生物屏障,否則特定部位的治療藥物遞送仍將是一個遙遠的現實。因此我們可以針對藥物遞送中出現的生物屏障對納米顆粒進行設計,合理地結合創新的設計特征,這將創造新一代的納米治療藥物,實現基于納米顆粒的藥物遞送的成功轉變。
二、圖文導讀
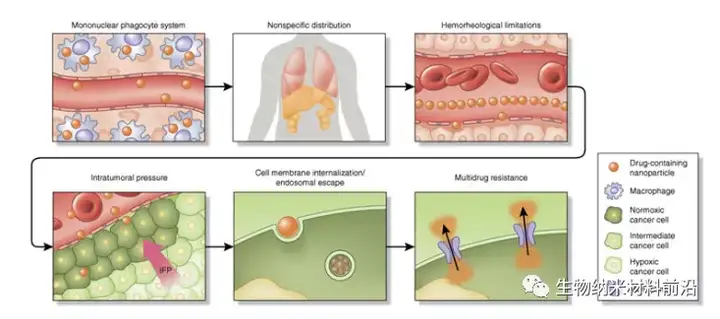
圖1. 納米顆粒藥物遞送的連續生物屏障框架。在靜脈內給藥時,含有藥物的納米顆粒會遇到許多阻礙有效的、特定于位點的遞送障礙。納米粒子經過調理作用,隨后被 MPS 的常駐巨噬細胞攝取。這會使得納米顆粒在器官(如脾臟和肝臟)中大量積累,從而導致納米治療藥物向健康器官的非特異性分布。在血管的正常流動條件下,納米顆粒的尺寸和幾何形狀血管壁的邊緣動態有很大影響。小尺寸球形顆粒在無細胞層中遷移,距離內皮表面相當遠,通過被動靶向機制(例如 EPR)限制了主動靶向策略和有效積累。腫瘤中納米顆粒積累的另一個重要障礙是高腫瘤內壓力,這是由中斷的脈管系統、細胞生長的侵襲性、纖維化、致密的細胞外基質和受損的淋巴管引起的。細胞內化和內體逃逸被也是另一個強大的障礙,納米顆粒的大小和表面修飾影響其內化途徑(例如網格蛋白與小窩蛋白)和細胞內流向。在低 pH 值環境和酶作用下,內化納米顆粒的內體區室化證明對細胞有害,尤其是對遺傳物質。最后一個障礙是納米顆粒在進入細胞后,賦予治療抗性的藥物外排泵將化療藥物從細胞中排出,IFP及間質液壓力在其中起到關鍵作用。
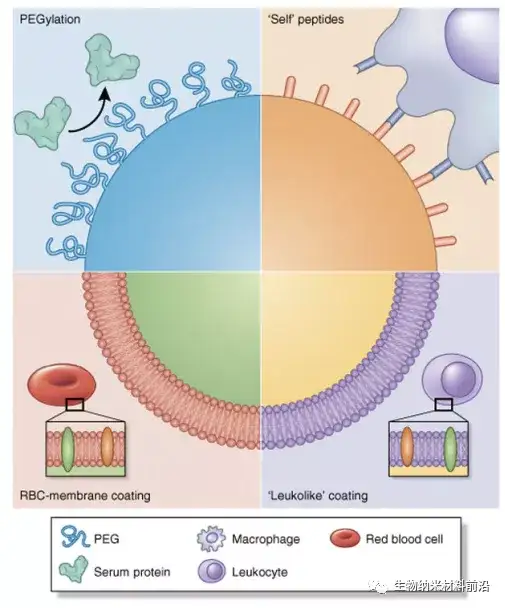
圖2.用于避免 MPS 和延長循環的納米顆粒仿生策略。MPS 的調理作用和契合已被證明不利于納米顆粒的長循環時間,因此,我們使用了幾種策略來“偽裝”納米粒子并防止蛋白質吸附。聚乙二醇化代表了一種經典的策略,其中將 PEG 接枝到表面提供了一個水合層,阻礙了蛋白質電暈的形成。在另一種策略中,CD47 肽附著在納米顆粒的表面,然后巨噬細胞將納米顆粒識別為“自身”,從而納米顆粒避免吞噬作用。最后,用從自體白細胞和紅細胞 (RBC)中提取的細胞膜涂覆納米顆粒提供了一個仿生表面,顯著延長納米顆粒的體內循環。
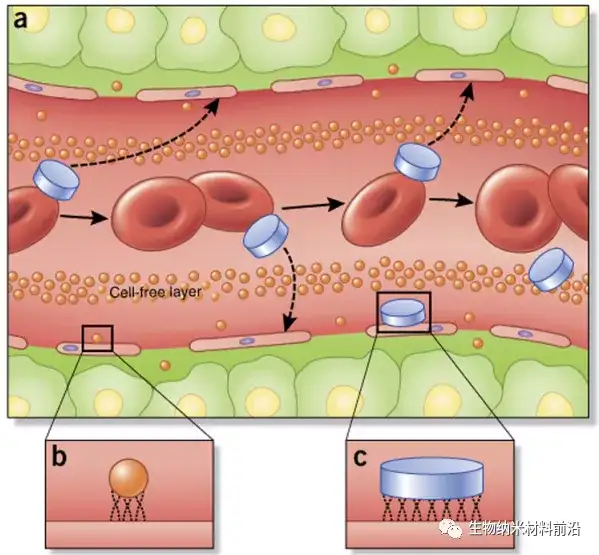
圖3. 納米粒子在血管中的流動、邊緣和粘附特性取決于粒子大小和幾何形狀。 (a) 與球形納米顆粒不同,非球形顆粒,例如那些具有盤狀幾何形狀的顆粒,更容易在脈管系統中產生翻滾和振蕩效應,大大增加了納米顆粒與細胞壁接觸的傾向以及通過脈管系統中的開窗可能外滲。(b,c) 一旦與內皮細胞接觸,常規球形納米粒子的小尺寸和表面積 (b) 與較大的盤狀納米粒子(c;以及其他非球形幾何形狀)相比,減少了結合和接觸點的數量, 這會影響腫瘤的積累和主動靶向策略。
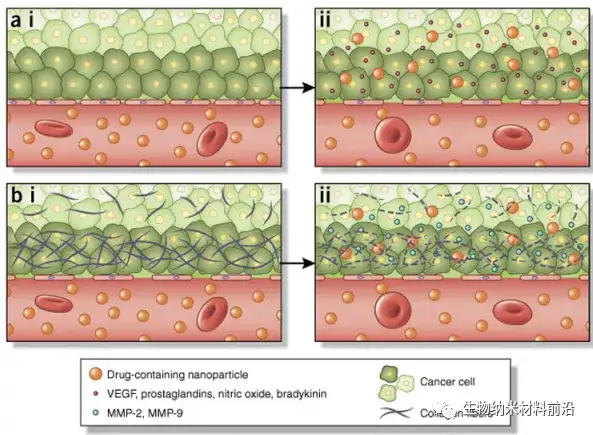
圖4. 納米顆粒引起腫瘤組織滲透性增強的決定因素。 EPR效應3是一種運輸現象,其主要特征是腫瘤脈管系統中存在開窗,使納米粒子在腫瘤中被動積累。(a,i) 正常脈管系統通常具有緊密的內皮間連接,可防止顆粒外滲到組織中。幾個因素的不平衡會影響腫瘤血管系統中開窗的大小。(a,ii) 例如,VEGF 和一氧化氮已被證明可以增加內皮細胞間隙的大小。(b,i) 腫瘤通常具有致密的細胞外基質,阻止納米顆粒充分滲透到腫瘤中。(b,ii) MMP-2 和 MMP-9 降解構成基底膜的致密膠原基質。反過來,這些可以在藥理學上加以利用(例如,通過施用抗纖維劑)來增強 EPR 效應,從而增加腫瘤中納米顆粒的積累。
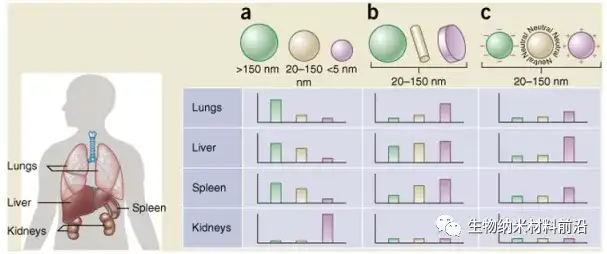
圖5.納米顆粒的大小、形狀和表面電荷決定了其在不同器官(包括肺、肝、脾和腎)之間的生物分布。 (a) 球形顆粒,包括金納米顆粒、脂質體和聚合物膠束/納米顆粒,其大小可能不同,并顯示出不同的體內流向。直徑 > 2,000 nm 的大剛性顆粒很容易在脾臟和肝臟以及肺的毛細血管中積聚;直徑為100-200 nm 范圍內的納米顆粒通過腫瘤的血管開窗滲出(EPR 效應)并逃脫肝臟和脾臟的過濾;隨著尺寸增加到超過 150 nm,越來越多的納米顆粒被包裹在肝臟和脾臟中;小尺寸納米顆粒 (<5 nm) 被腎臟過濾掉。(b) 新的“自上而下”和“自下而上”制造技術使探索納米粒子的不同幾何形狀成為可能,包括圓柱形和盤狀形狀,已顯示出對藥代動力學和生物分布的顯著影響。不同的納米顆粒形狀表現出獨特的流動特性,顯著改變循環壽命、細胞膜相互作用和巨噬細胞攝取,進而影響不同器官之間的生物分布。(c) 源自不同表面化學物質的納米粒子的電荷影響調理作用、循環時間以及與包含 MPS 的器官的常駐巨噬細胞的相互作用,帶正電荷的粒子更容易被肺、肝臟和脾臟中的巨噬細胞隔離。中性和帶輕微負電荷的納米粒子在 MPS的上述器官中具有更長的循環壽命和更少的積累。在 b 和 c 中,假設的納米顆粒尺寸范圍為 20-150 nm。值得注意的是,體內生物分布無疑會根據上述幾個參數的相互作用而變化。
三、全文總結
目前,納米顆粒的藥物遞送領域正在超越傳統的范圍(例如,傳統的幾何形狀、尺寸或化學物質),這利于設計出專門負責克服連續生物障礙的納米顆粒。人們越來越意識到,雖然納米顆粒對于治療腫瘤過程中的生物屏障確實很復雜,但它們絕不是不可克服的。正如此處所強調的,創新設計實施,例如使用非傳統幾何形狀來改善血管動力學或使用仿生膜功能化以避免吞噬細胞攝取,這已顯示出優于現有常規納米顆粒的明顯優勢。盡管該領域正在思考克服生物障礙更合理的方法,但這些都應圍繞著與這些系統相關的額外復雜性,這將直接影響規模化、大規模生產和相關成本的難易程度。此外,根據設計實施(例如,添加自體細胞衍生的仿生表面),有關質量控制、可重復性和毒性的監管批準等方面可能是額外的障礙。進一步了解控制這些生物屏障及它們在各種疾病狀態下的轉變,再加上材料科學的創新,將繼續促進納米粒子的開發,這些納米粒子能夠解決這些障礙,以實現有效的、特定于位點的遞送。這不僅會導致新療法的成功轉化,而且還將把基于納米顆粒的藥物遞送從一個有前途的領域提升為治療多種疾病的可行且常見的策略。
文章鏈接:
Doi:10.1038/nbt.3330.

本信息源自互聯網僅供學術交流 ,如有侵權請聯系我們立即刪除。
| 溫馨提示:蘇州北科納米供應產品僅用于科研,不能用于人體,不同批次產品規格性能有差異。網站部分文獻案例圖片源自互聯網,圖片僅供參考,請以實物為主,如有侵權請聯系我們立即刪除。 |
下一篇: 納米醫學產品1


