上海大學王艷麗AFM:細胞器特異性錨定遞送系統可聯合化療-光熱治療逆轉腫瘤乏氧微環境
發布時間:2021-12-27 11:33:24 人氣:2202

傳統的靶向遞送系統主要是通過病理組織遞送而實現細胞膜靶向并在細胞質中釋放藥物。遞送系統可以通過EPR效應首先到達腫瘤組織,并穿過生物屏障,聚集在一個特定的細胞器中。然而,只有一小部分治療藥物可成功到達特異性細胞器靶點。因此,直接遞送至亞細胞器是解決由于缺乏特異性而導致的高劑量要求和全身毒性的關鍵。與真核細胞的其他細胞器相比,具有雙層膜的線粒體是細胞產生ATP的動力源和武器庫。除了產生能量外,它們還參與多種生理活動,包括活性氧(ROS)產生、線粒體自噬、代謝、穩態和細胞凋亡。此外,線粒體也被證實易受高熱的影響。這些特點使藥物的線粒體特異性遞送成為提高療效的可行策略。
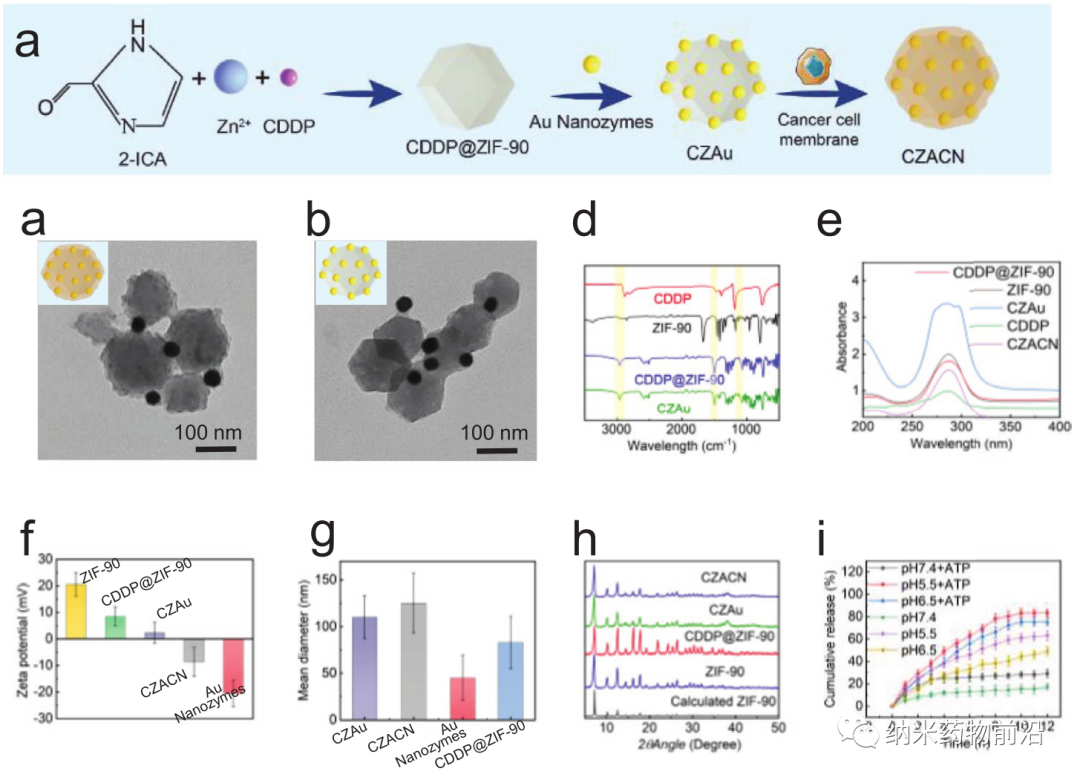
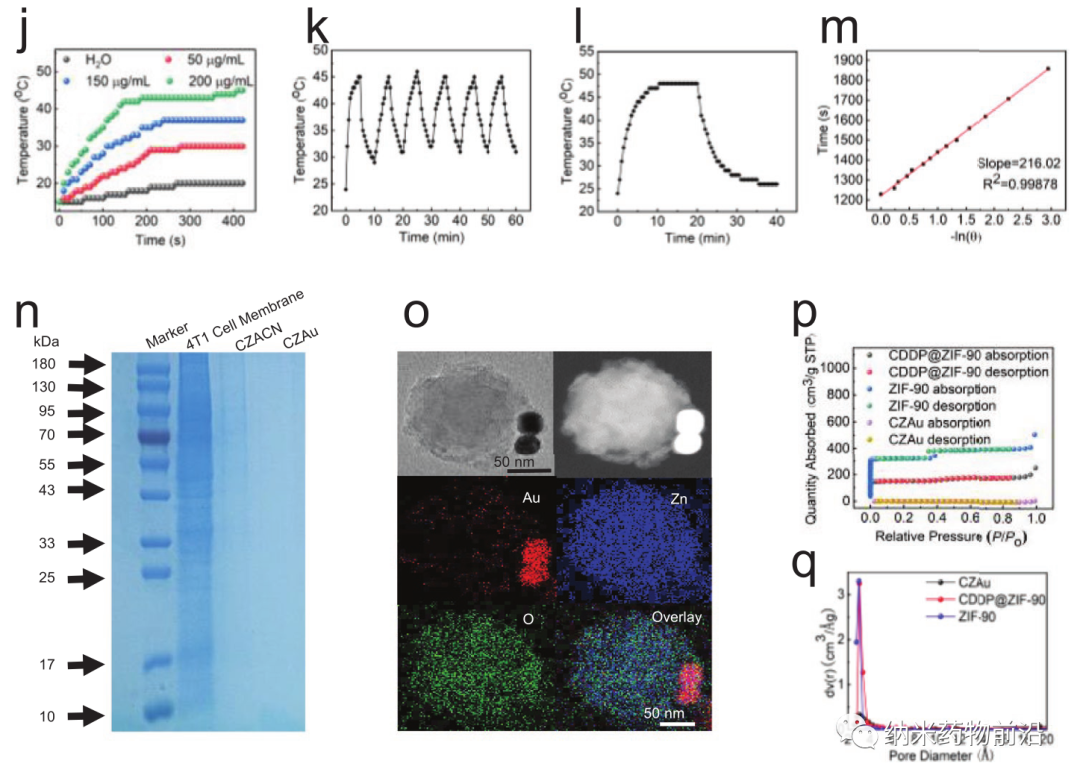
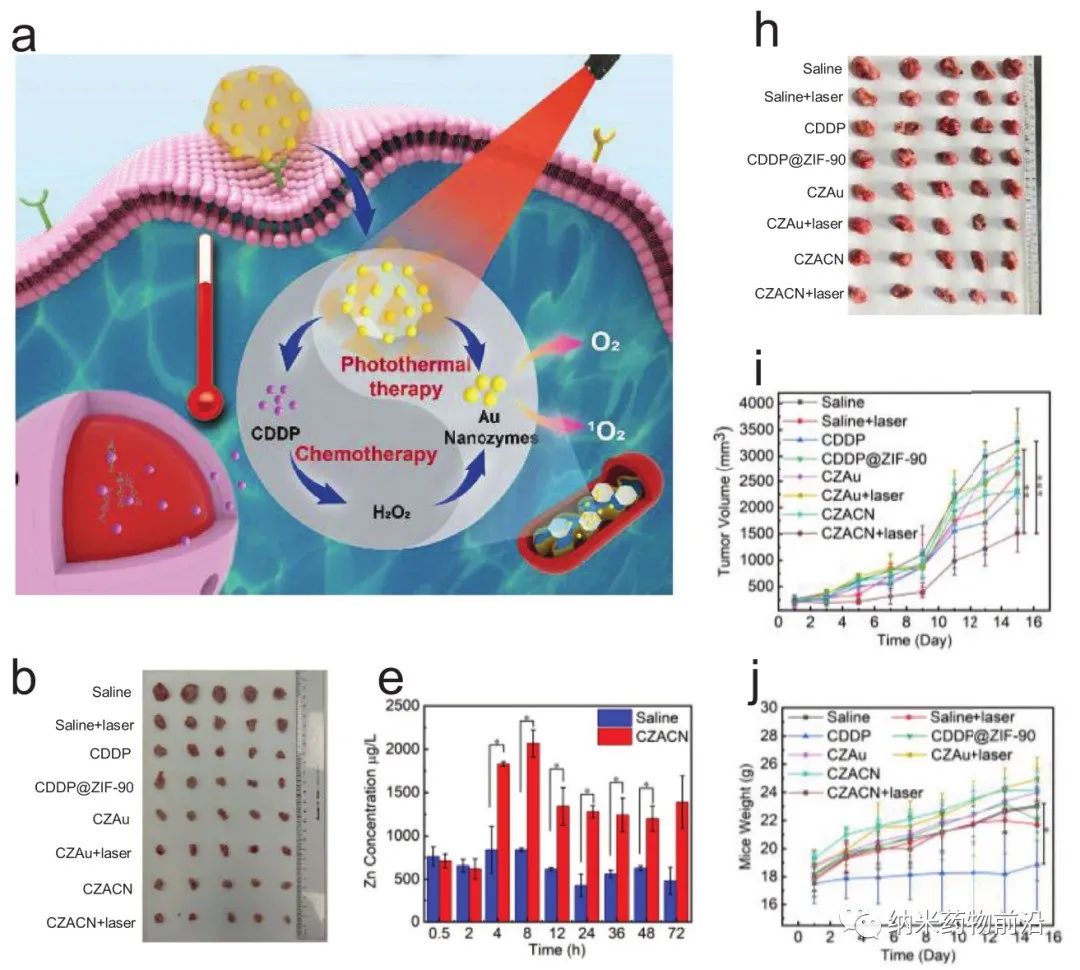
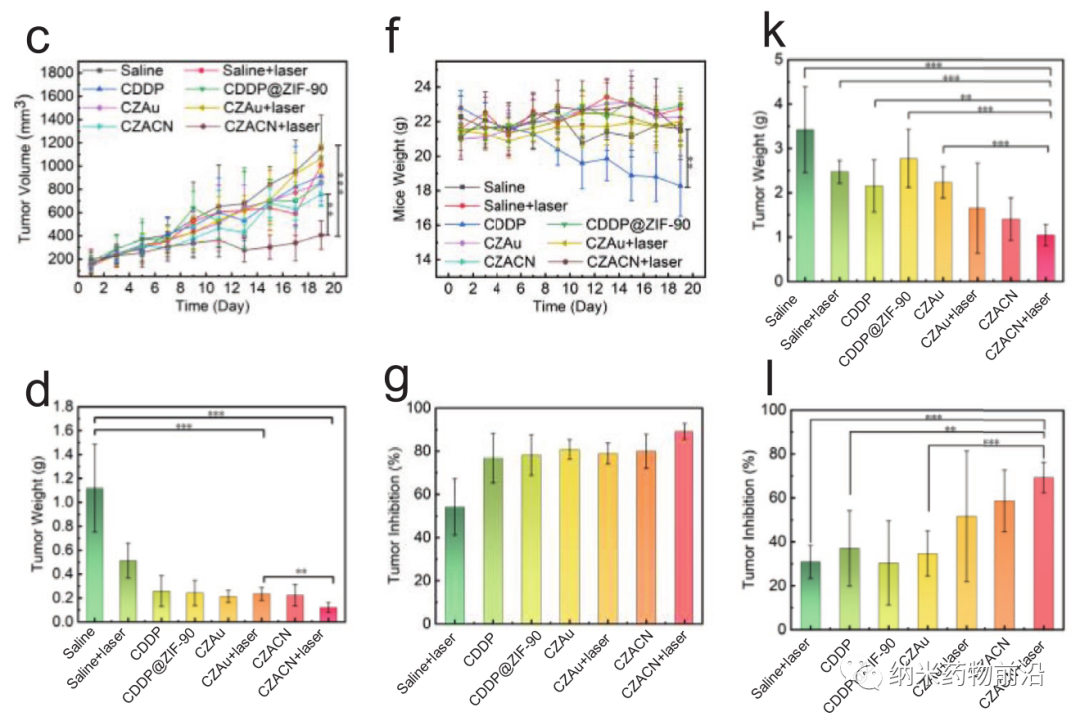
在此,上海大學王艷麗教授設計了一種線粒體靶向納米平臺(CZACN)。它由用于線粒體特異性遞送的ZIF-90、用于逃避免疫系統和靶向同源細胞的癌細胞膜、用于化療的順鉑(CDDP)、用于氧自給和光熱治療的金納米酶組成。ZIF-90從其他金屬有機框架中產生,由于ATP與鋅的競爭性配位導致其結構解體,因此ZIF-90對高ATP劑量環境具有敏感性。由于線粒體中的ATP含量幾乎比細胞外環境高25倍,因此鋅離子會從ZIF-90中解離出來,刺激ROS生成,最終導致細胞凋亡。ZIF-90可進一步被攜帶有癌細胞蛋白和抗原的癌細胞膜包裹,從而可以逃離免疫系統,靶向同源腫瘤細胞。CDDP是典型的鉑基藥物之一,與細胞核DNA相互作用形成Pt-DNA加合物,切斷基因復制和轉錄,最終導致細胞凋亡和細胞死亡。它能激活NADPH氧化酶,產生O2•−,在癌細胞中產生H2O2。然而,由于CDDP可受腫瘤低氧微環境的影響,抑制Pt-DNA加合物的形成,因此可導致劑量限制性毒性。為了緩解腫瘤乏氧微環境,作者用ZIF-90包覆金納米酶。ZIF-90具有模擬酶催化特性,催化性能和穩定性均優于天然過氧化氫酶。它們能在近紅外光照射下催化過量的H2O2產生O2和單線態氧,緩解腫瘤乏氧,增強對癌細胞的毒性。此外,金納米酶在激光(650-1100 nm)照射下具有良好的光熱轉換效果。實驗表明,CZACNs具有氧自給、細胞器特異性釋放和光熱轉換特性。此外,在近紅外照射下,腫瘤生長抑制率可達到89.2±3.70 %,并降低了CDDP引起的劑量限制性毒性。近紅外下52 ℃輕度熱療也可增強其通透性和流動性,最終增加其胞內蓄積,提高化療-光熱治療的效果。
| 溫馨提示:蘇州北科納米供應產品僅用于科研,不能用于人體,不同批次產品規格性能有差異。網站部分文獻案例圖片源自互聯網,圖片僅供參考,請以實物為主,如有侵權請聯系我們立即刪除。 |
下一篇: 納米醫學產品1


