中山大學毛宗萬Angew:錨定碳酸酐酶IX (CAIX)的錸(I)光敏劑引起焦亡增強抗腫瘤免疫
發布時間:2021-12-02 19:51:05 人氣:1800

理想的腫瘤治療既要破壞原發腫瘤,又要提高腫瘤微環境的免疫原性,以達到良好的抗腫瘤免疫效果。為此,中山大學毛宗萬設計了一種錨定碳酸酐酶IX (CAIX)的錸(I)光敏劑,命名為CA-Re,不僅能在低氧下高效地進行I型和II型光動力治療(PDT),而且可通過誘導gasdermin D (GSDMD)介導焦亡,有效刺激腫瘤免疫原性。CA-Re能同時破壞和自我報告膜完整性的丟失。促進樹突狀細胞(dendritic cells, DCs)的成熟和抗原呈遞,并在體內充分激活T細胞依賴的適應性免疫反應,最終在消滅原發腫瘤的同時消滅遠端腫瘤。而CA-Re是第一個基于金屬絡合物的焦亡誘導劑,這一研究為腫瘤的金屬免疫治療提供了一個新的角度。
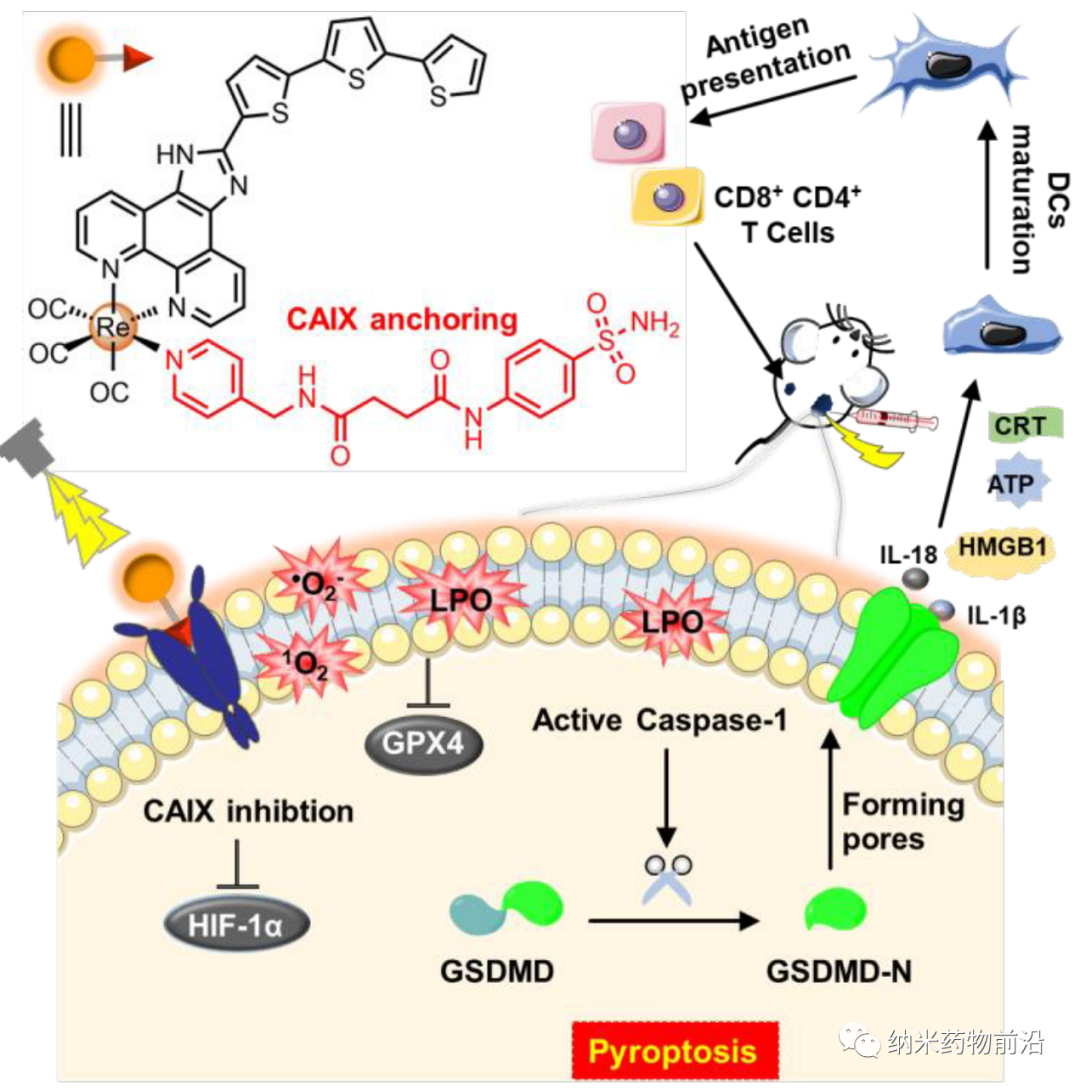
隨著免疫檢查點阻斷療法(ICB)在一些晚期癌癥中的臨床成功,免疫治療引起了廣泛的關注。然而,其對惡性腫瘤如三陰性乳腺癌(mTNBC)和結直腸癌的治療效果受到非免疫原性腫瘤微環境的嚴重限制。近年來,有大量的證據表明光動力療法(PDT)后會產生免疫刺激,提示它是一種潛在的免疫原性治療方法。PDT是一種利用光和無毒光敏劑通過氧依賴途徑(type-II)產生單線態氧(1O2),或通過氧不依賴途徑(type-I)產生其他活性氧(ROS),以時間和空間選擇性破壞腫瘤組織的無創臨床治療方法。在某些情況下,PDT可以誘導細胞釋放損傷相關分子 (DAMPs),從而增強癌細胞的免疫原性并激活全身適應性免疫反應。然而,大多數光敏劑必須與ICB聯合使用(如抗CTAL4、抗PD-L1)才能達到較好的抗腫瘤免疫效果,但成本高,副作用嚴重。其缺乏普遍性和有效性的原因主要在于: (1) 腫瘤缺氧嚴重限制了PDT的效率,促進了免疫抑制; (2) PDT通常誘導細胞凋亡,由于緩慢或甚至不釋放DAMPs,其免疫原性較差。因此,為了實現有效的抗腫瘤免疫,迫切需要能夠在缺氧條件下實現高PDT效率并以高免疫原性誘導細胞死亡而不是凋亡的新型光敏劑。細胞焦亡是一種獨特的程序性細胞死亡形式。炎性caspases裂解gasdermin D (GSDMD)被認為是介導焦亡的關鍵事件,其釋放N-末端結構域(GSDMD- N)與膜磷脂結合并在細胞膜上鉆孔。結果,細胞膜的滲透電位被破壞,導致細胞腫脹、細胞膜破裂和炎癥因子(如IL-1β、IL-18)的快速釋放。研究發現,由焦亡引起的炎癥反應能激發較強的抗腫瘤免疫,增強ICB的療效。因此,焦亡為高免疫原性光敏劑的設計提供了新的方向。
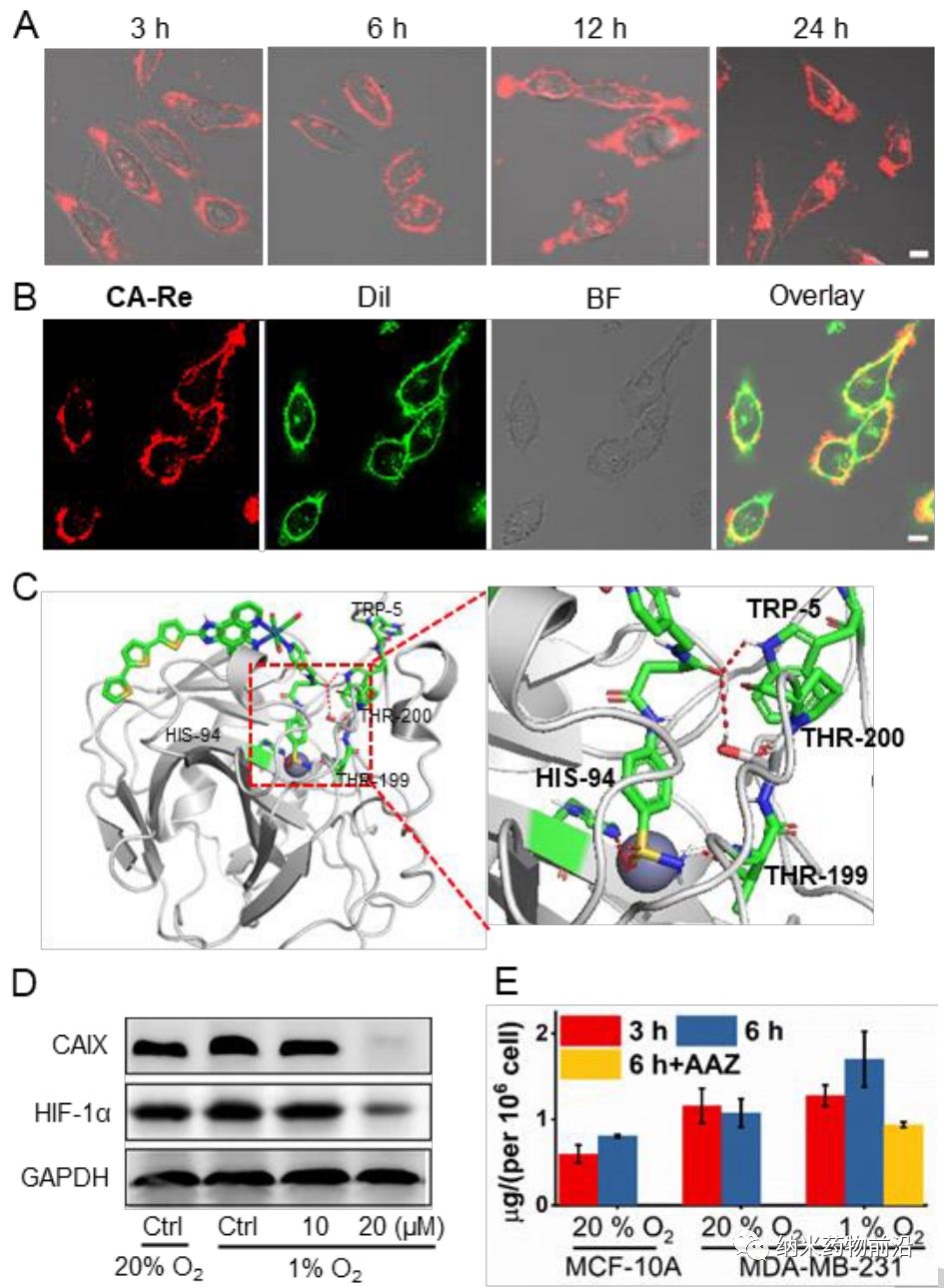
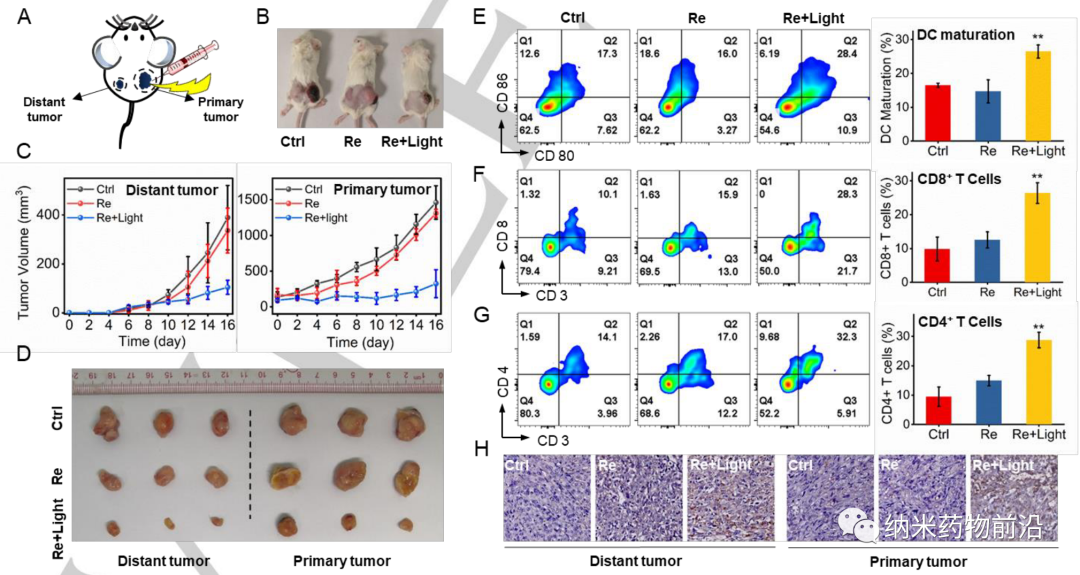
由于CAIX是一種跨膜蛋白,僅在腫瘤而非正常組織中過表達。其轉錄受缺氧誘導因子(HIF-1α)的調控。作者設計了一個含有苯磺酰胺尾部的吡啶基配體,這是CAIX結合鋅活性中心常用的部分。然后將該單齒配體與脫氯的Re(CO)3(N^N)Cl前體在四氫呋喃中反應合成新型光敏劑CA-Re,然后通過柱層析(CH2Cl2/CH3OH)純化。經表征和性質結果表明,CA-Re具有優良的光穩定性,即使輻照后也不釋放吡啶配體。此外CA-Re擁有CAIX錨定和干預能力,使其能夠固定在細胞膜上,在一定程度上緩解腫瘤缺氧。這促進了膜上原位ROS的產生和脂質的過氧化,最終在缺氧條件下表現出極高的PDT效率(納摩爾水平的光毒性),并有效地引發gasdermin D介導的焦亡。在此過程中,CA-Re引起并自我報告細胞膜完整性的喪失。因此,一系列炎癥因子和DAMPs在治療部位迅速釋放,刺激樹突狀細胞成熟和抗原提呈,最終在體內激活T細胞依賴的適應性免疫反應,在破壞原發腫瘤的同時抑制遠端腫瘤的生長。
https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.202115800
本信息源自互聯網僅供學術交流 ,如有侵權請聯系我們立即刪除。
| 溫馨提示:蘇州北科納米供應產品僅用于科研,不能用于人體,不同批次產品規格性能有差異。網站部分文獻案例圖片源自互聯網,圖片僅供參考,請以實物為主,如有侵權請聯系我們立即刪除。 |
下一篇: 納米醫學產品1


