乳腺癌術后治療:可注射雙層凝膠實現索拉非尼和抗CD47抗體的貫序釋放
發布時間:2021-11-11 09:59:29 人氣:1644
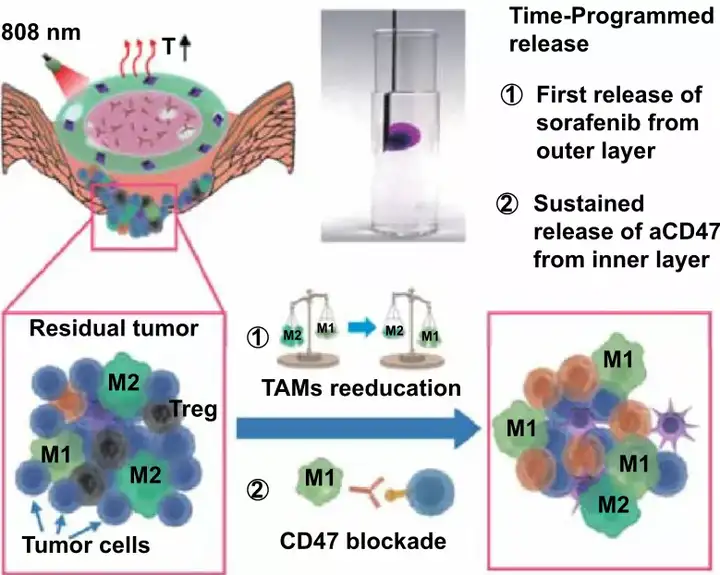
乳腺癌細胞的高侵襲性以及手術切除后的高度免疫抑制微環境導致化療、放療以及免疫療法等治療方法效果受限。由于巨噬細胞具有可塑性,將促進腫瘤生長的M2型腫瘤相關巨噬細胞(Tumor-associated macrophages, TAMs)通過“再教育”為具有抗腫瘤活性的M1型,有望逆轉術后免疫抑制微環境。此外,抗CD47抗體(aCD47)通過阻斷CD47與信號調節蛋白α(SIRPα)的相互作用,能夠激活吞噬細胞與效應T細胞介導的免疫應答,增強抗腫瘤療效。因此,本研究提出假設:在CD47免疫阻斷治療之前,優先對腫瘤術后的TAMs進行再“再教育”,有望建立一個整體免疫有利的微環境,以提高抗腫瘤效果。
Time-Programmed Delivery of Sorafenib and Anti-CD47 Antibody via a Double-Layer-Gel Matrix for Postsurgical Treatment of Breast Cancer
Liping Huang, Yiyi Zhang, Yanan Li, Fanling Meng, Hongyu Li, Huimin Zhang, Jiasheng Tu, Chunmeng Sun*, Liang Luo*
Nano-Micro Letters (2021)13: 141
https://doi.org/10.1007/s40820-021-00647-x
本文亮點
1. 開發了一種新型可注射雙層凝膠;
2. 分層結構的雙層脂質凝膠可實現藥物時間貫序釋放;
3. 證實了優先釋放適宜劑量的索拉菲尼能夠對腫瘤相關巨噬細胞進行“再教育”并增強抗CD47抗體的效果。
內容簡介
華中科技大學羅亮教授與中國藥科大學孫春萌副教授聯合團隊在這項研究中構建了由不同比例的大豆卵磷脂/二油酸甘油酯組成的可注射雙層凝膠,以實現貫序釋藥、逆轉免疫微環境,并且結合免疫阻斷療法,從而更好地防止乳腺癌術后復發與轉移。雙層凝膠的外層具有熱響應性,并負載吸附有索拉菲尼(SRF)的氧化石墨烯(GO)納米粒子。GO在人工控制的近紅外照射下產生較為溫和的熱量,首先刺激SRF的釋放,對TAMs進行再“再教育”,促進免疫原性微環境的形成。內層凝膠負載aCD47,能夠長時間維持凝膠狀態,使得aCD47持續釋放,阻斷CD47與SIRPα通路,實現長期的抗腫瘤效果。體內4T1荷瘤小鼠模型研究表明,基于雙層凝膠的貫序釋藥策略通過逆轉局部免疫抑制,協同阻斷CD47介導的免疫逃逸,能夠增強全身免疫反應,有效地防止腫瘤復發與轉移。
圖文導讀
I 雙層凝膠的設計與表征
分別制備包封SRF@GO(SG)的外層凝膠前體和包封aCD47的內層凝膠前體,并分別裝入雙筒注射器中。如圖1所示,依次注射后,可形成界限分明的雙層凝膠。體內外光熱性能考察結果顯示,雙層凝膠光熱性能良好,升溫隨功率可調且2分鐘之內便可達到所需溫度。體外實驗中外層包載SG,內層使用IgG模擬aCD47。
結果均表明能夠實現良好的貫序釋藥,即外層通過光控釋藥優先釋放,內層則長效緩釋。體內實驗中使用Ce6模擬SRF,AFIgG模擬aCD47,同樣證明可實現貫序釋藥。
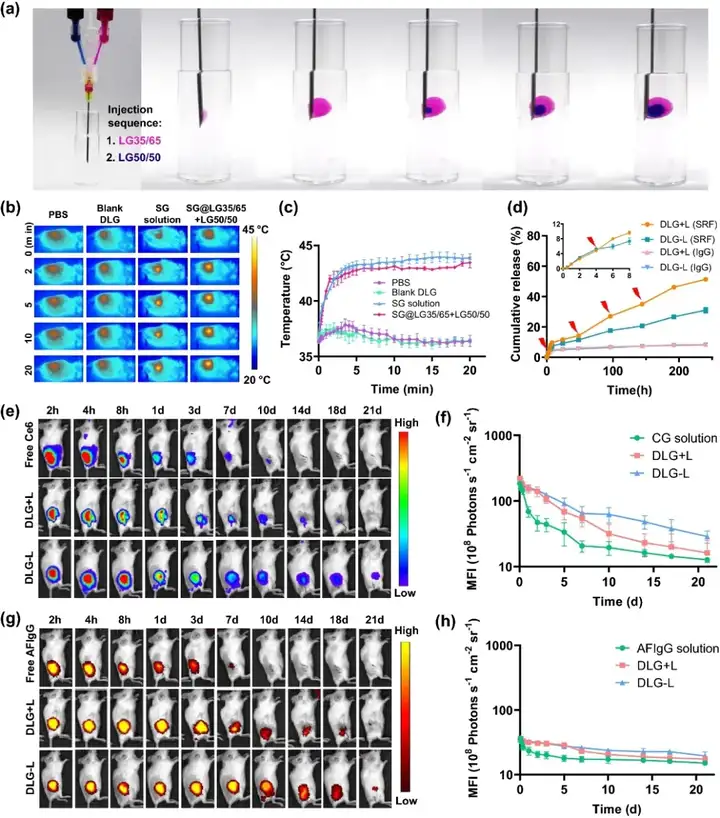
圖1. (a) 使用雙筒注射器形成雙層凝膠示意圖;(b, c) 4T1-luc荷瘤小鼠術后經PBS、Blank DLG、SG溶液和LG50/50+SG@LG35/65治療后施加808 nm激光照射20分鐘內溫度變化情況(n=3);(d) 體外光控釋放SRF和長效緩釋IgG的累計釋放量(n=3);(e, f) 小鼠體內熒光成像Ce6剩余情況(n=3);(g, h) 小鼠體內熒光成像AFIgG剩余情況(n=3)。
IISRF的最優釋放方案篩選
SRF對巨噬細胞的調節和抗腫瘤療效具有劑量依賴性,因此篩選最適合本研究的索拉菲尼釋放方案對于免疫微環境的調節和腫瘤治療至關重要。如圖2所示,本研究控制不同組別藥物劑量一致,即aCD47為70 μg/只,SRF為50 μg/只。通過改變內外層凝膠體積比、光照時間與光照頻率,從而改變內外層凝膠的釋放速率,以篩選調節腫瘤免疫微環境(Tumor microenvironment, TME)的最優方案。最終確定內外層凝膠各50 μL,于第0天、2天、4天和6天每次光照20分鐘為最優治療方案。
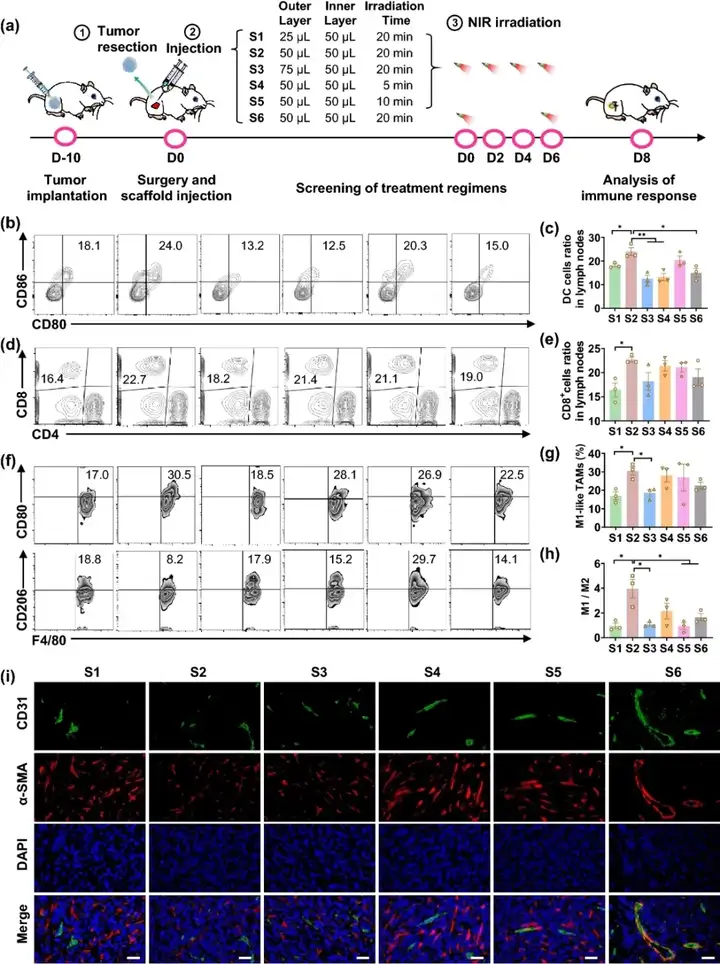
圖2. (a) 不同治療策略篩選示意圖;(b, c) 引流淋巴結中DC細胞浸潤情況(n=3);(d, e) 引流淋巴結中CD4⁺和CD8⁺ T細胞浸潤情況(n=3);(f-h) 腫瘤中巨噬細胞浸潤情況(n=3);(i) 各組第8天腫瘤微血管免疫熒光染色。(比例尺:100 μm)。
III體內抗腫瘤療效
通過構建不完全切除的4T1-luc荷瘤小鼠模型,即待腫瘤生長至約300 mm3時,切除約90%的腫瘤,留下大約10%的腫瘤,模擬術后未完全切除的腫瘤模型。
對小鼠按照以下6組方案進行治療:PBS不加光組(PBS組,G1)、雙層未載藥凝膠不加光組(LG35/65+LG50/50組,G2)、aCD47與SG混合溶液加光組(G3)、外層凝膠未載藥內層載aCD47不加光組(LG35/65+aCD47@LG50/50組,G4)、外層凝膠載SG內層未載藥加光組(SG@LG35/65+LG50/50組,G5)、外層凝膠載SG內層載aCD47不加光組(SG@LG35/65+aCD47@LG50/50-L組,G6)與外層凝膠載SG內層載aCD47加光組(SG@LG35/65+aCD47@LG50/50+L組,G7)。其中,內外層凝膠的體積均為50 μL,aCD47劑量均為70 μg/只,索拉菲尼的劑量均為50 μg/只。加光組小鼠分別于0、2、4 、6d施加808 nm激光光照,每次20 min。使用熱成像儀持續實時監測小鼠腫瘤部位溫度,手動調節激光器功率,使照射部位溫度維持在42~45℃,并利用4T1-luc腫瘤細胞的發光信號檢測腫瘤的生長情況。如圖3所示,在23天的治療期間,G7組,即SG@LG35/65+aCD47@LG50/50+L組腫瘤熒光明顯弱于其他各組。第23天時小鼠的腫瘤體積和質量也明顯低于其他各組,血管的CD31和α-SMA信號較其他各組弱此外,G7組小鼠的生存期也得到明顯延長。這表明SG@LG35/65+aCD47@LG50/50+L的策略能夠有效抑制腫瘤復發及腫瘤血管新生。

圖3. (a) 藥效及免疫應答實驗設計示意圖;(b) 4T1-luc荷瘤小鼠術后經各組治療后的腫瘤熒光成像;(c) 4T1-luc荷瘤小鼠術后經各組治療后腫瘤生長曲線(n=5);(d) 治療后第23天每組代表性小鼠腫瘤質量;(e) 小鼠生存曲線(n=8);(f)各組第8天腫瘤微血管免疫熒光染色。(比例尺:100 μm)。
IV 免疫應答效果考察
基于上述對于腫瘤復發的良好抑制效果,本文于術后第8天對淋巴結和腫瘤部位的其他免疫細胞水平進行檢測,進一步對于貫序釋放索拉菲尼和aCD47的雙層凝膠免疫應答效果進行考察。如圖4所示,G7組的M1型巨噬細胞為19.4%,而G1組僅為8.2%;G7組的M2型巨噬細胞為8%,而G1組高達為21%,這表明索拉菲尼能夠對巨噬細胞進行有效地“再教育”。對于血清中細胞因子的水平進行檢測,結果顯示,G7組治療后,包括IFN-γ、TNF-α和IL-2在內的促炎細胞因子水平上調,這幾種細胞因子可由M1型巨噬細胞分泌,并能夠輔助T細胞介導的抑瘤免疫作用。相反,與其他組小鼠相比,G7組由M2型巨噬細胞分泌的免疫抑制性細胞因子IL-10水平顯著下降。
本文進一步對其他免疫細胞水平進行考察,如圖5所示,G7組小鼠淋巴結中成熟的DC細胞最多,約為20.8%,淋巴結中的CD8⁺ T細胞和CD4⁺ T細胞浸潤最多。同時,與G1組相比,負載aCD47的G3和G4組的小鼠成熟的DC細胞和CD8⁺ T細胞的水平也明顯升高,這表明aCD47能夠有效激活T細胞介導的免疫應答。與淋巴結中結果相似,G7組的腫瘤組織中CD8⁺ T細胞和CD4⁺ T細胞浸潤最多,而具有抑制細胞毒性T淋巴細胞抗腫瘤免疫效果的Treg細胞水平最低。這說明該種策略能夠有效地逆轉術后免疫抑制微環境,塑造腫瘤部位的免疫原性微環境。
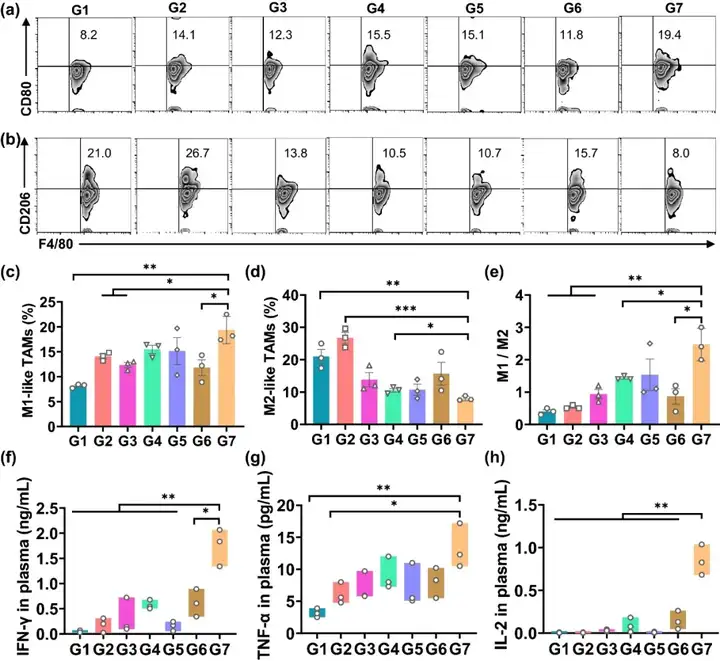
圖4. (a, b) M1型、M2型巨噬細胞的流式分析圖;(c) M1型巨噬細胞的比例統計;(d) M2型巨噬細胞的水平統計;(e) M1型、M2型巨噬細胞的比值;(f) 各組小鼠血清中IFN-γ的水平統計;(g) 各組小鼠血清中TNF-α的水平統計;(h) 各組小鼠血清中IL-2的水平統計。
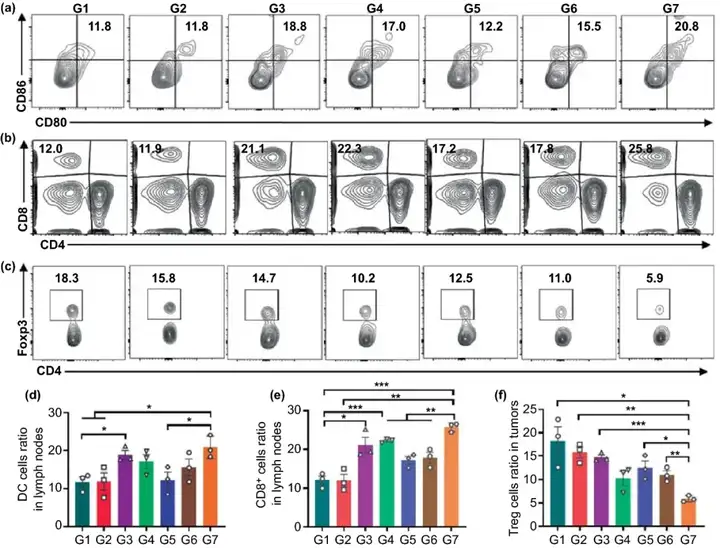
圖5. (a) DC細胞的流式分析圖;(b) 引流淋巴結中CD4⁺和CD8⁺ T細胞的流式分析圖;(c) Treg細胞的流式分析圖;(d) DC細胞的水平統計;(e) CD8⁺ T細胞的水平統計;(f) Treg細胞的水平統計。
V 長期免疫記憶效果考察
最后,本研究使用更具侵略性的全身擴散腫瘤模型對貫序釋放索拉菲尼和aCD47的雙層凝膠能否誘導全身免疫記憶進行探究。如圖6所示,G7組的肺轉移情況明顯低于其他各組。對各組肺結節數目的統計結果同樣顯示,G7組的肺結節數目明顯低于其他組,甚至比PBS組低16倍。這說明本研究的程序性釋放索拉菲尼和aCD47,使用光熱聯合免疫阻斷療法的策略能夠有效激發機體的全身免疫應答,有效地組織腫瘤的自發性轉移。本研究進一步對該種策略產生的免疫記憶效果進行進一步驗證。效應記憶T細胞(Effector memory T cells, TEM)可被立即激活發揮效應,而中央記憶T細胞(Central memory T cells, TCM)則需要較長的時間產生細胞毒性T細胞。在注射4T1-luc細胞的次日,G7組小鼠的淋巴結中TEM的比例最高,并且G7組的TCM與除了G3組之外的其余各組對比數量也有所增加。這些結果進一步表明,基于程序性釋放索拉菲尼和aCD47、光熱療法聯合免疫阻斷療法的策略有利于建立長期的抗腫瘤免疫記憶。
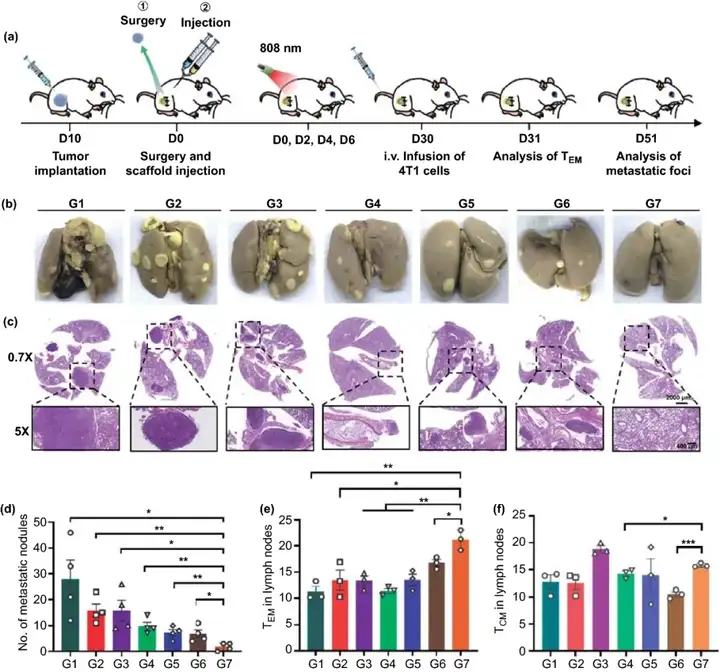
圖6. (a) 免疫記憶效果及抑制肺轉移實驗設計示意圖;(b, c) 各組小鼠術后51天肺轉移情況;(d) 各組小鼠術后51天肺結節數目統計(n=4);(e) 靜脈注射4T1-luc細胞次日小鼠淋巴結中TEM細胞水平;(f) 靜脈注射4T1-luc細胞次日小鼠淋巴結中TCM細胞水平。
作者簡介

羅亮
本文通訊作者
華中科技大學 教授▍主要研究領域
新功能材料的合成及在醫學影像、生物檢測、藥物遞送等方面的應用研究。
▍主要研究成果
自2018年來以通訊作者在Journal of the American Chemical Society、Nature Communications、Advanced Materials、Advanced Functional Materials等期刊已發表近30篇高水平論文,獲批中國發明專利10余項。曾任美國康涅狄格州美中醫藥開發協會會長,回國后作為課題負責人承擔國家重點研發計劃“納米專項”、國家自然科學基金面上項目等,先后入選國務院僑務辦公室重點華人華僑創業團隊、武漢市光谷3551創新人才計劃等,并擔任中國抗癌協會納米腫瘤學青年專業委員會副主任委員、中國化學會分子聚集發光專業委員會委員、中國生物物理學會材料生物學與智能診療技術分會副秘書長。
▍Email: liangluo@hust.edu.cn
▍課題組主頁
liangluogroup.wqdian.cn/

孫春萌
本文通訊作者
中國藥科大學 副教授▍主要研究領域
藥物新制劑和制劑新技術、智能納米藥物遞送系統、腫瘤免疫治療、靶向性細胞穿膜肽的設計、仿制藥質量一致性評價、藥用輔料相關研究等。
▍主要研究成果
已發表論文40余篇,其中以第一作者和通訊作者在Nature Communications, Advance Functional Materials, Journal of Controlled Release等國際權威期刊發表SCI論文20余篇。以第一發明人申請專利2項。作為主要完成人,獲2016年江蘇省教育科學研究成果獎科技進步獎三等獎。2017年,接受《江蘇科技報》“人物”欄目專訪。2017-2018年,參與國家藥品審評中心《藥物注射劑研發技術指導意見》、《已上市化學仿制藥(注射劑)一致性評價技術要求》等文件起草工作。為2020年版《中國藥典》制修訂指導原則和通用檢查法5項。另參編國家藥典委員會專著《各國藥用輔料標準對比手冊》、國家高等醫藥院校藥學類雙語教材《藥劑學實驗與指導》等。
▍Email: suncmpharm@cpu.edu.cn

黃麗萍
本文第一作者
華中科技大學▍主要研究領域
多功能納米生物材料用于診療一體化、多功能腫瘤靶向納米遞藥系統的研究。
▍主要研究成果
發表SCI論文10余篇,獲專利10余項。
▍Email: lphuang@aliyun.com

張一漪
本文第一作者
華中科技大學▍主要研究領域
腫瘤光療免疫聯合療法、腫瘤藥物遞送。
▍Email: yiyizhang@hust.edu.cn

李亞楠
本文第一作者
南京師范大學▍主要研究領域
藥物遞送與腫瘤免疫。
▍主要研究成果
發表SCI論文10余篇,獲專利3項。
▍Email: liyanan@njnu.edu.cn
撰稿:原文作者
編輯:《納微快報(英文)》編輯部
本信息源自互聯網僅供學術交流 ,如有侵權請聯系我們立即刪除。
| 溫馨提示:蘇州北科納米供應產品僅用于科研,不能用于人體,不同批次產品規格性能有差異。網站部分文獻案例圖片源自互聯網,圖片僅供參考,請以實物為主,如有侵權請聯系我們立即刪除。 |
下一篇: 納米醫學產品1


