AM封面:免疫治療新突破-內(nèi)源特異性TAMs靶向仿生納米紅細(xì)胞遞送系統(tǒng)增強(qiáng)化療免疫治療
發(fā)布時(shí)間:2021-10-29 11:22:32 人氣:1315

概要:
由腫瘤細(xì)胞、基質(zhì)細(xì)胞和浸潤(rùn)的免疫細(xì)胞構(gòu)成的高度復(fù)雜的腫瘤免疫抑制微環(huán)境(TIME)是導(dǎo)致腫瘤化療和免疫治療的治療效率較低的重要原因。腫瘤相關(guān)巨噬細(xì)胞(TAMs)是最豐富的腫瘤浸潤(rùn)白細(xì)胞之一,特別是M2型TAMs在促進(jìn)腫瘤生長(zhǎng)、血管新生、腫瘤轉(zhuǎn)移及免疫逃逸等方面發(fā)揮重要作用。因此通過清除或極化M2型腫瘤相關(guān)巨噬細(xì)胞有望重塑腫瘤免疫抑制微環(huán)境來(lái)提高腫瘤治療的效果。但是由于巨噬細(xì)胞在體內(nèi)廣泛分布和在先天免疫中的關(guān)鍵作用,生物安全性是基于TAMs治療的主要障礙。因此,如何實(shí)現(xiàn)M2型TAMs的特異性靶向治療一直是研究的瓶頸難題。
近日,南方醫(yī)科大學(xué)藥學(xué)院周東方教授團(tuán)隊(duì)聯(lián)合東北師范大學(xué)黃宇彬教授團(tuán)隊(duì)在國(guó)際著名學(xué)術(shù)期刊Advanced Materials(DOI: 10.1002/adma.202103497)(IF:30.849)在線發(fā)表題為“EngineeringEndogenous Tumor-Associated Macrophage-Targeted Biomimetic Nano-RBC toReprogram Tumor Immunosuppressive Microenvironment for EnhancedChemo-Immunotherapy”的研究論文,并當(dāng)選為封面文章(InsideFront Cover)。該研究設(shè)計(jì)合成了一種血紅蛋白聚偶聯(lián)自組裝仿生納米紅細(xì)胞系統(tǒng)(V(Hb))用于運(yùn)送化療藥物阿霉素(DOX)和氧氣來(lái)重新編程腫瘤免疫微環(huán)境。利用血紅蛋白能夠與內(nèi)源性血漿結(jié)合珠蛋白(Hp)自發(fā)結(jié)合并通過CD163表面受體特異性靶向M2型巨噬細(xì)胞的特點(diǎn),使該藥物遞送系統(tǒng)V(Hb)@DOX能夠?qū)崿F(xiàn)對(duì)M2型TAMs的內(nèi)源特異性靶向殺傷,并且血紅蛋白的攜氧功能能夠改善腫瘤的乏氧微環(huán)境,從而對(duì)TIME進(jìn)行重塑,實(shí)現(xiàn)高效的癌癥化療-免疫治療聯(lián)合治療。在原位小鼠乳腺癌(4T1)轉(zhuǎn)移模型還是皮下小鼠結(jié)腸癌(CT26)的術(shù)后復(fù)發(fā)模型中,V(Hb)@DOX均能夠顯著減少腫瘤內(nèi)TAMs和相關(guān)免疫抑制因子,增加T細(xì)胞浸潤(rùn),有效地抑制了腫瘤轉(zhuǎn)移和復(fù)發(fā),并極大地降低了小分子藥物的相關(guān)毒性。
該研究提供了一種內(nèi)源特異性靶向TAMs的仿生納米紅細(xì)胞遞送系統(tǒng),能夠安全高效的靶向遞送化療藥物與氧氣,協(xié)同重塑TIME,在癌癥TAMs靶向免疫治療中的應(yīng)用前景廣闊。周東方教授為本文的最后通訊作者,東北師范大學(xué)黃宇彬教授為共同通訊作者,南方醫(yī)科大學(xué)在站博士后王玉鵬為第一作者,該論文得到了國(guó)家自然科學(xué)基金委等項(xiàng)目支持。
亮點(diǎn):
1.構(gòu)建血紅蛋白基仿生納米紅細(xì)胞的藥物遞送系統(tǒng),利用血紅蛋白代謝特性,實(shí)現(xiàn)內(nèi)源性和特異性靶向M2型TAMs。
2.內(nèi)源特異性靶向殺傷結(jié)合供氧協(xié)同降低腫瘤內(nèi)TAMs含量,重塑TIME。
3.重塑TIME,實(shí)現(xiàn)安全高效的癌癥化療-免疫治療聯(lián)合治療,有效抑制腫瘤生長(zhǎng)、轉(zhuǎn)移與復(fù)發(fā)。
原理圖:
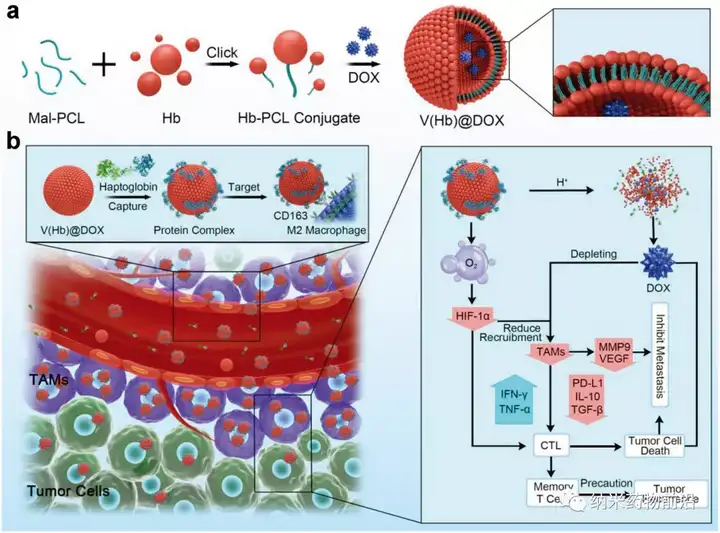
圖1、工程化內(nèi)源性TAMs靶向仿生納米紅細(xì)胞重編程腫瘤免疫微環(huán)境以增強(qiáng)癌癥化療免疫治療的示意圖。a)仿生納米紅細(xì)胞藥物遞送系統(tǒng)(V(Hb)@DOX)原理圖設(shè)計(jì)。b)內(nèi)源特異性TAMs靶向V(Hb)@DOX通過重編程TIME增強(qiáng)化療免疫治療的示意圖。

全文鏈接:https://onlinelibrary.wiley.com/doi/10.1002/adma.202103497
封面鏈接:https://onlinelibrary.wiley.com/doi/10.1002/adma.202170304
本信息源自互聯(lián)網(wǎng)僅供學(xué)術(shù)交流 如有侵權(quán)請(qǐng)聯(lián)系我們立即刪除
| 溫馨提示:蘇州北科納米供應(yīng)產(chǎn)品僅用于科研,不能用于人體,不同批次產(chǎn)品規(guī)格性能有差異。網(wǎng)站部分文獻(xiàn)案例圖片源自互聯(lián)網(wǎng),圖片僅供參考,請(qǐng)以實(shí)物為主,如有侵權(quán)請(qǐng)聯(lián)系我們立即刪除。 |


