劉宗文、劉艷平、武明花等綜述:基于時間分辨熒光成像顯微鏡的癌癥診斷與治療效果監測
發布時間:2021-10-18 09:50:26 人氣:1310
時間分辨熒光技術經歷30年的發展,已經在生物醫學領域的應用得到了廣泛的研究。而癌癥由于其高發性和高死亡率是當今醫學領域研究的重中之重,時間分辨熒光技術在輔助癌癥診斷、腫瘤手術邊緣確定以及靶向藥物遞送等領域得到了研究和應用。同時NAD(P)H自發熒光、FRET技術和熒光修飾的生物傳感器的高速發展,FLIM技術的應用范圍也得到了進一步拓展。本文主要聚焦于FLIM技術結合自發熒光分子、FRET熒光基團對和生物傳感器在癌癥診斷和療效監測應用的相關研究,并分析了當今技術發展的不足和未來在癌癥領域FLIM技術的發展方向。
1. 綜述了FLIM聯合NAD(P)H、FRET和生物傳感器在癌癥診斷和治療監測的應用。
2. 介紹了FLIM的原理及其臨床轉化發展歷程。
3. 討論了FLIM技術的不足及未來在癌癥診斷和抗癌治療的應用發展前景。
內容簡介
時間分辨熒光成像顯微鏡(FLIM)在過去的30年里得到了迅速的發展,并在生物醫學工程中得到了廣泛的應用。熒光標記探針設計的最新進展進一步拓寬了熒光的應用前景。由于熒光時間對微環境和分子層面改變更加敏感,故FLIM對疾病的診斷和療效評估極具應用前景。
目前癌癥相關的FLIM應用可分為三大類:(i) FLIM檢測以NAD(P)H為代表的胞內或胞外的自發熒光分子用于細胞代謝研究;(ii) FLIM結合熒光共振能量轉移用于蛋白質相互作用監測;(iii) FLIM結合熒光標記的生物傳感器進行癌癥異常分子檢測。納米材料和熒光時間快速計算技術的進展,以及新的癌癥生物標志物的發現,促進了FLIM的優化,為癌癥診斷和治療的醫學研究和臨床應用提供了更多的機會。
中南大學劉艷平教授,武明花教授;澳洲悉尼大學Zongwen Liu副教授等在本文中綜述了2015-2020年癌癥相關FLIM應用的前沿研究,討論了FLIM在未來癌癥診斷和抗癌治療的可能性,同時總結了當今FLIM發展的不足以及未來在癌癥領域的發展方向。
圖文導讀
I FLIM臨床應用發展
熒光時間憑借其對微環境改變敏感等諸多優勢在熒光成像領域得到了越來越多的應用,時間分辨熒光技術(FLIM)也隨之發展。自上個世紀八十年代,第一臺單分子計數-時間分辨熒光技術(TCSPC-FLIM)被發明以來,在FLIM成像速度,熒光時間測量準確性,分辨率等方面,FLIM得到了長足的發展,如雙光子和多光子熒光FLIM技術不但在實驗室層面得到了發展,也有越來越多的臨床FLIM器械得到研制并逐步走向臨床應用。而在生物醫學領域,FLIM也在胞內離子濃度,蛋白相互作用,皮膚病等多個領域具有發展潛力,本文則是基于當前癌癥高發生率和死亡率的現狀,從NAD(P)H自發熒光,熒光共振能量轉移(FRET)以及生物傳感器三個方面系統論述了近五年FLIM在癌癥早期診斷和療效監測上的應用。
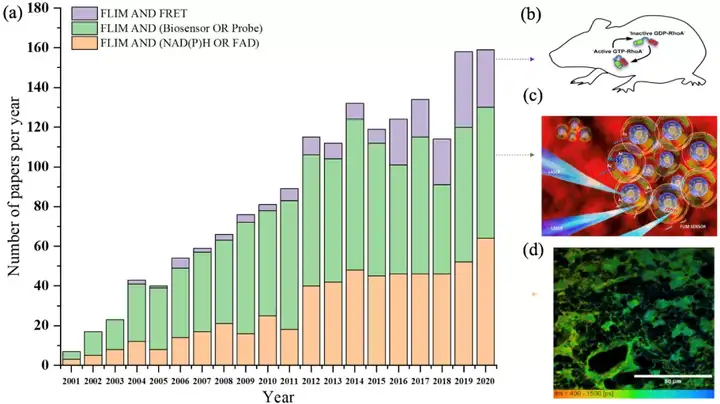
II FLIM的基本原理
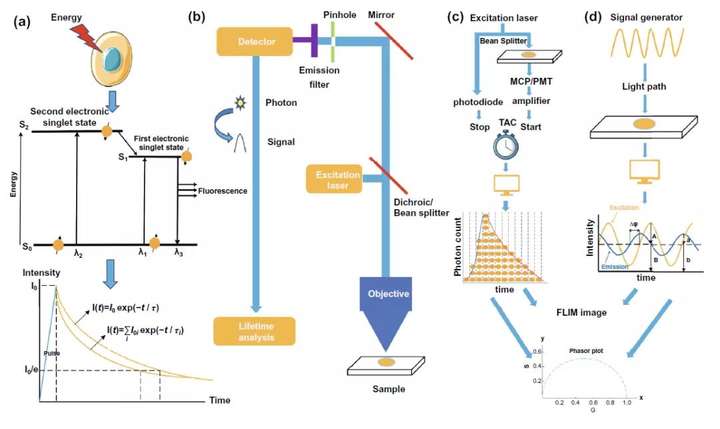
如圖2a所示,當分子被激發至激發態后,它將返回到基態,而熒光正是分子從激發態回到基態的一種能量輻射形式。熒光壽命可以被簡單地理解成一個物質中所有分子在激發態平均的“停留時間”,也可以經過精準的熒光強度衰減曲線記錄,將熒光強度從I₀衰減到I₀/e的時間視為熒光壽命。 而在時間分辨熒光顯微鏡(FLIM)的構造方面,圖2b介紹了FLIM是在熒光顯微鏡的基礎框架上融合單光子檢測器和光子計時裝置而進行研發。基于熒光時間的測量方式,FLIM可以分為時域和頻域兩類,時域中又可分為TCSPC,時間門控和條紋相機三大類,其中TCSPC-FLIM的基本原理如圖2c的示例圖所示,通過光電倍增管的信號放大以及時幅、幅電轉換將不同時刻檢測到的光子依據到達時間構建熒光強度衰減曲線從而得到熒光時間。而頻域FLIM的基本原理則是如圖2d所示,基于對激發光的調制和檢測信號的解調,利用對曲線相移等參數分析,獲得熒光時間。經過儀器測得的熒光衰減曲線,依據熒光來源于單個或多個熒光分子的區別可以通過單指數或多指數函數分析計算來分析得到熒光時間。為了規避上述兩種方法需要提前判斷熒光分子數目和精確擬合熒光衰減曲線的缺點,相量分析在熒光時間的分析領域方面得到了越來越多的應用。利用公式將FLIM儀器所測得的參數值轉換成繪制相量圖(Phasor Plot)所需的g值和s值,對得到的相量圖進行進一步的分析獲得檢測樣品中熒光分子數目及各自的熒光時間等信息,并可以此為基礎繪制FLIM圖像。
III FLIM結合NAD(P)H分子的自發熒光用于癌細胞代謝監測
基于還原型煙酰胺腺嘌呤二核苷酸(磷酸)(NADH,NADPH)和氧化型黃嘌呤二核苷酸(FAD)的自發熒光特性,以及如圖3b所示的在細胞糖酵解和三羧酸循環過程以及后續氧化磷酸化(OXPHOS)過程中NADH、FAD等分子的變化,利用FLIM檢測這些自發熒光分子熒光時間的變化可以實現對癌細胞胞內代謝的監測。而在這個部分,依據直接檢測參數的不同,又可以分為熒光時間、比值和相量圖以及多參數FLIM三個部分。
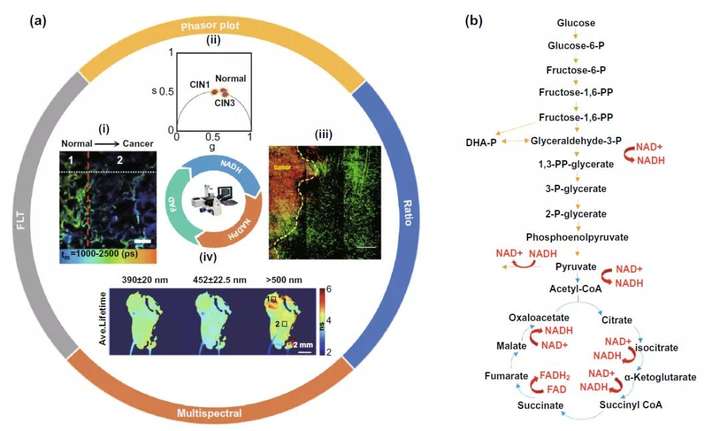
在熒光時間部分,值得先說明的是,在氧化磷酸化過程中由于NADH分子會與輔酶結合而呈現蛋白質結合NADH狀態,NADH分子的熒光時間將會從0.4 ns增長至2 ns。而上個世紀由Warburg提出的Warburg效應又指出癌細胞較正常組織細胞更喜歡在細胞胞質內利用糖酵解進行能量供應同時抑制通過三羧酸循環和氧化磷酸化產生ATP,故癌細胞中的熒光時間往往短于正常組織細胞,利用這一特性可以實現如圖3a-i所示的腫瘤手術切除邊緣的確定。但最近也有越來越多的研究發現,以腫瘤干細胞為代表的腫瘤細胞并不遵守Warburg效應,具體原因還有待探究。
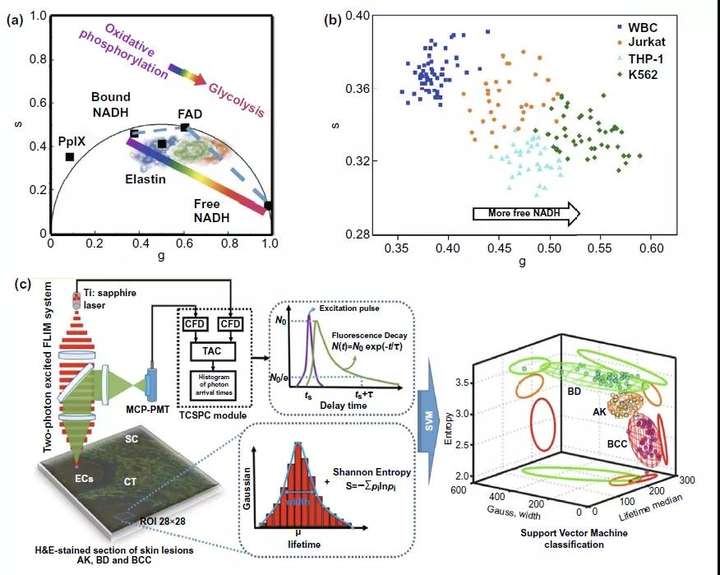
而比值和矢量圖部分則是基于代謝過程中這些自發熒光分子形式的變化,利用比值放大代謝發生前后差異,達到靈敏檢測的目的。如圖3a-iii所示,利用糖酵解過程中增高的NADH/NAD+比值和腫瘤細胞的Warburg效應原理,可以幫助確定腫瘤手術切除邊緣。而相量圖則是通過多種自發熒光分子如彈性蛋白(elastin),FAD,尤其是游離型和蛋白結合型NADH在代謝過程中的改變導致的熒光時間變化(圖4a),反應細胞內free-NADH/bound-NADH的比值變化,實現在宮頸癌癌前病變(圖3a-ii)、白血病細胞亞型分類(圖4b)等多個臨床領域的應用。
在多參數FLIM領域內,多光譜FLIM(ms-FLIM)用于癌癥的診斷往往集中在口腔癌前病變(圖3a-iv)以及皮膚基底細胞癌等領域。同時,利用計算機對以高斯分布、信息熵以及熒光時間的分析處理,包含熒光時間的多參數分析處理模型也有望輔助臨床上以基底細胞癌診斷為代表的多種皮膚疾病的診斷分型(圖4c)。
IV FLIM結合熒光共振能量(FRET)技術的應用
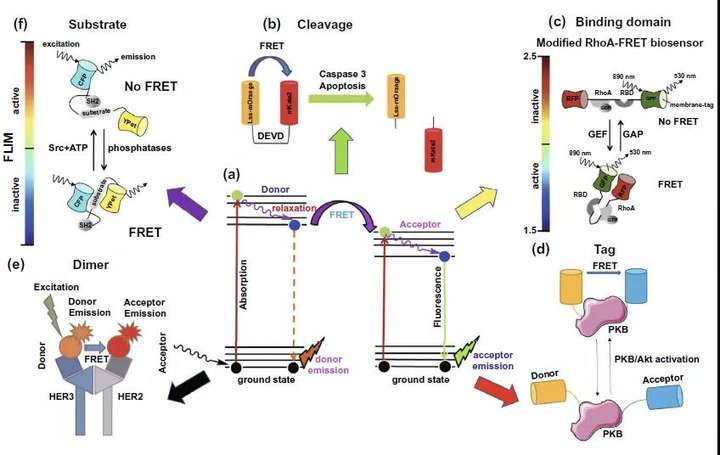
如圖5a所示,熒光共振能量轉移(FRET)發生在特定條件下的供體和受體熒光分子之間,利用全反射熒光顯微鏡(TIRF)或者時間分辨熒光顯微鏡(FLIM)可以實現對FRET效率或者供體熒光分子熒光時間衰減的檢測。FRET-FLIM在癌癥領域的檢測應用依據采取的FRET熒光對的不同類型可以分為五類,熒光對裂解型(cleavage),結合域型(Binding domain),蛋白熒光分子標記型(Tag),二聚物型(Dimer)和底物分子反應型(Substrate)。熒光對裂解型主要針對產生切割效應的蛋白質的活性檢測,如圖5b中所示的caspase3的活性檢測。Binding domain型則往往是利用靶標分子與不同底物結合時的構象差異導致的FRET發生與否的后果,實現對靶標蛋白的活性檢測,如圖5c中所示的RhoA蛋白。利用Tag型則是基于靶標蛋白構象改變導致相連的FRET熒光對的FRET現象變化來實現活性的間接檢測,圖5d針對的目標即是PKB蛋白活性檢測。至于Dimer型熒光分子對結合FLIM的應用多見于在細胞膜或外泌體上會發生二聚化的受體數量或活性檢測,如表皮生長因子受體家族HER2,HER3受體就是研究的代表(圖5e)。最后一類底物型基本模式與Tag型很接近,兩者的最大區別在于Tag型是靶標蛋白自身被激活導致的自身構象改變使得FRET效應發生變化,而底物型的靶標蛋白是通過使它的目標底物發生構象變化,而達到目標底物上相連的FRET熒光對的FRET變化,以進行活性檢測(圖5f)。通過對胞內或膜上蛋白質數量或者活性的改變從分子水平上達到癌癥診斷或者抗癌治療療效評估的目的,提升癌癥患者的預后。
V FLIM結合熒光標記探針的應用
5.1 胞內分子變化FLIM檢測
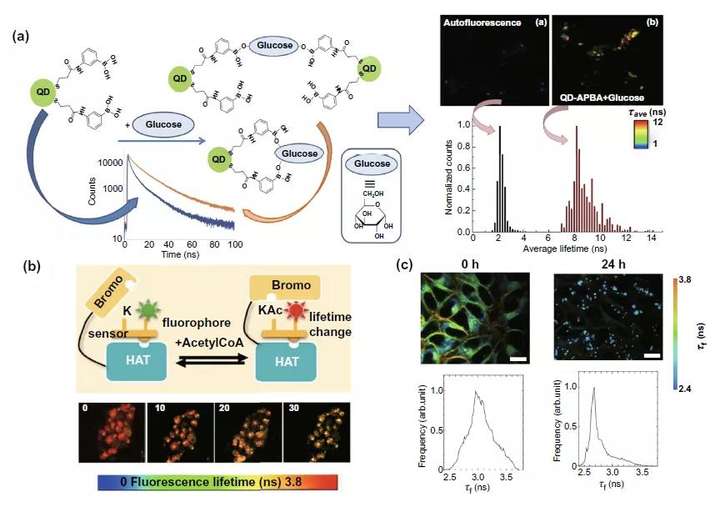
細胞內的分子變化FLIM檢測可以分為核內和細胞質內兩類,在細胞核內部分圖6a論述的是結合一種乙酰轉移酶活性生物傳感器(HATS)實現對乙酰轉移酶活性的檢測從而輔助針對組蛋白乙酰化的抗癌藥物療效評估。在細胞質內,FLIM則可以結合新型量子點和熒光標記的香豆素探針實現對細胞質內兩大代謝情況-糖代謝和脂代謝的監測,輔助癌細胞的代謝研究和臨床診治應用(圖6a,c)。
5.2 膜結構變化FLIM檢測
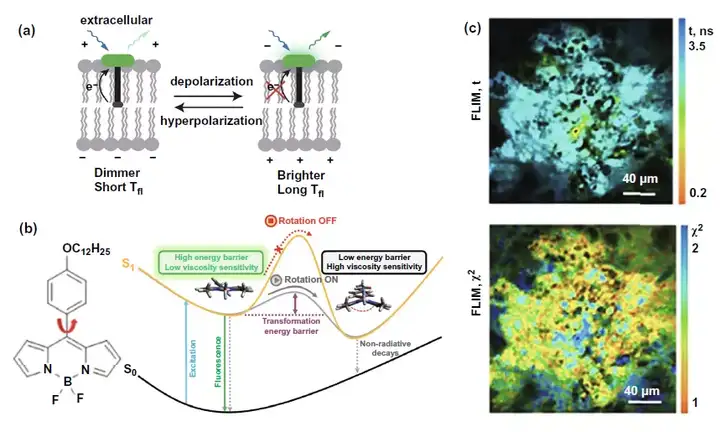
由于FLIM檢測膜上受體變化情況已在FLIM-FRET部分詳細論述,在這一部分主要聚焦于FLIM結合熒光探針檢測細胞膜和線粒體膜的電勢以及膜黏度變化的應用。這些參數與細胞膜通透性等指標相關,間接反映細胞惡性轉化等細胞活動。在膜電勢測量領域,圖7a選擇的代表性研究是利用FLIM檢測VoltageFluor熒光染料標記探針的熒光時間,由于膜去極化時削弱了光誘發的電子轉移,導致從超極化到去極化時檢測到的熒光時間將會延長。而在膜黏度測量領域,熒光探針大多基于圖7b左圖所示的氯化硼絡合二吡絡甲川結構(BODIPY)。如圖7b右圖所示,當膜黏度升高時將會提升從熒光探針從平面構型轉換到蝶式構型的能量壁壘,導致激發態回到基態的非輻射性途徑削弱,從而使得以熒光為代表的能量輻射途徑增強,熒光時間延長。圖7c即是使用BODIPY2探針結合FLIM實現對體內CT26腫瘤的FLIM成像,檢測細胞膜黏度。
5.3 腫瘤細胞外環境FLIM檢測
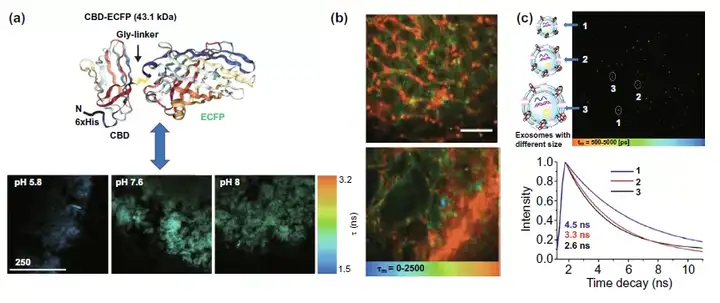
在腫瘤細胞外環境中,主要討論了結合熒光探針、量子點等熒光材料是否有望實現對腫瘤微環境的pH,血管構成以及外泌體進行檢測。使用融合有ECFP熒光蛋白的CBD-ECFP分子可以實現利用熒光時間反映體外基質中pH的目的(圖8a)。而腫瘤血管成像則是基于血液中循環的量子點的長時熒光特性,探究腫瘤組織和正常組織血管形態差異(圖8b)。而圖8c則是利用膜黏度探針的熒光時間反映外泌體的膜黏度從而得到外泌體大小的信息,有望用于臨床癌癥早期診斷。
5.4 FLIM檢測具有熒光發射的抗癌藥物遞送
圖9a是利用FLIM探究帶有OG熒光標記的外泌體和微囊泡紫杉醇遞藥方式入胞機制,研究發現外泌體主要通過胞吞方式入胞,而微囊泡則通過胞吞和與細胞膜融合兩種方式入胞。而在脂質體遞藥策略(liposome)研究中,圖9b的研究中使用FLIM探究了體內遞送過程中生物分子冠狀物在脂質體周圍形成導致載藥泄露的問題。除了前面兩類抗癌藥物遞送策略,近年來以納米結構為基礎的抗癌藥物遞送新策略不斷涌現,一種如圖9c所示的PAH-Cit-Dox的納米遞送策略得到了構建和實驗室研究,使用FLIM得到FLIM相量圖(Phasor plot)和相量區分的熒光時間像素圖(PDLPI)對阿霉素的釋放和其在細胞內的分布進行了監測,輔助遞送策略優化和療效提升。

VI總結與展望
1. FLIM成像速度,分辨率提升以及與其它光學技術的整合成像。
2. FLIM走向臨床應用在熒光分子生物相容性、靶向性,以及深層次穿透能力如近紅外熒光分子研究仍需進行。
3. FLIM結合NAD(P)H自發熒光用于代謝檢測可以拓寬至腫瘤微環境中的免疫細胞、神經元等,輔助腫瘤免疫治療等研究。
4. 利用熒光探針結合FLIM有望實現腫瘤外泌體中RNA檢測,而以阿霉素(Dox)為代表的抗癌藥物遞送也可與外泌體策略結合,使用FLIM監測優化。
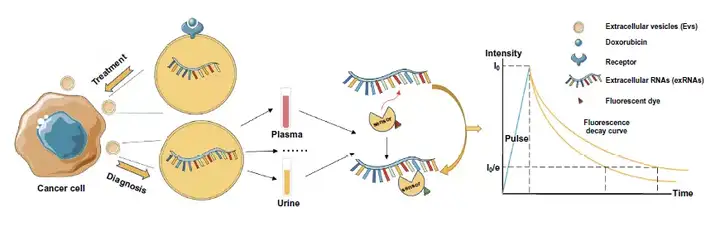
圖10. 外泌體-FLIM應用于外泌體RNA檢測和抗癌藥物遞送的設計思路。
本信息源自互聯網僅供學術交流 如有侵權請聯系我們立即刪除
| 溫馨提示:蘇州北科納米供應產品僅用于科研,不能用于人體,不同批次產品規格性能有差異。網站部分文獻案例圖片源自互聯網,圖片僅供參考,請以實物為主,如有侵權請聯系我們立即刪除。 |
下一篇: 納米醫學產品1


