比利時(shí)Braeckmans教授:納米氣泡光孔法高效轉(zhuǎn)染mRNA
發(fā)布時(shí)間:2021-10-09 09:32:45 人氣:1341
通過轉(zhuǎn)染核酸進(jìn)行高效、安全的細(xì)胞工程仍然是基礎(chǔ)生物醫(yī)學(xué)研究和許多新的治療應(yīng)用(如基于cart細(xì)胞的治療)的長(zhǎng)期障礙之一。近年來,mRNA作為一種比基于病毒或DNA轉(zhuǎn)座子的方法更安全、更通用的替代工具越來越受到關(guān)注。然而,現(xiàn)有非病毒性mRNA傳遞途徑的局限性阻礙了這些難以轉(zhuǎn)染免疫細(xì)胞的基因工程的進(jìn)展。
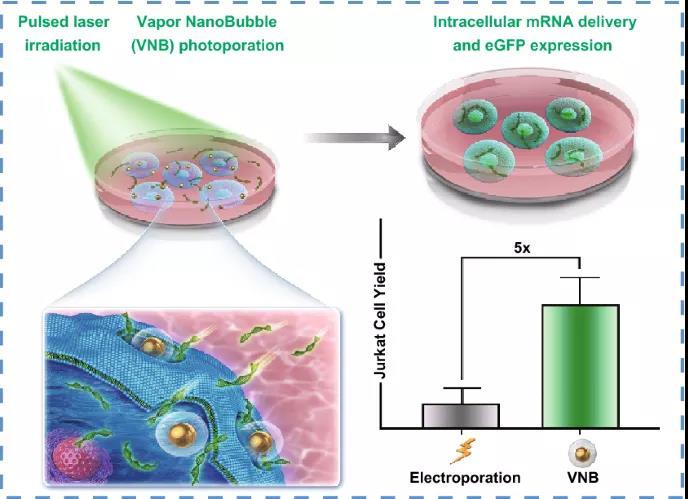
Intracellular Delivery of mRNA in Adherent and Suspension Cells by Vapor Nanobubble Photoporation
Laurens Raes, Stephan Stremersch, Juan C. Fraire, Toon Brans, Glenn Goetgeluk, Stijn De Munter, Lien Van Hoecke, Rein Verbeke, Jelter Van Hoeck, Ranhua Xiong, Xavier Saelens, Bart Vandekerckhove, Stefaan De Smedt, Koen Raemdonck, Kevin Braeckmans
Nano‑Micro Lett.(2020)12:185
本文亮點(diǎn)
1. 蒸氣納米氣泡VNB光穿孔是一種很有前途的轉(zhuǎn)染貼壁細(xì)胞和懸浮細(xì)胞mRNA的物理技術(shù)。
2. 與VNB光穿孔過程相關(guān)的參數(shù)被優(yōu)化以實(shí)現(xiàn)高效的mRNA轉(zhuǎn)染。
3. VNB光穿孔產(chǎn)生的活體轉(zhuǎn)染Jurkat T細(xì)胞是電穿孔的五倍,即目前用于T細(xì)胞的標(biāo)準(zhǔn)非病毒轉(zhuǎn)染技術(shù)與電穿孔相比。
內(nèi)容簡(jiǎn)介
比利時(shí)根特大學(xué)Kevin Braeckmans教授等在本研究中,證明金納米粒子介導(dǎo)的蒸氣納米氣泡(VNB)光穿孔是一種有前途的物理轉(zhuǎn)染方法,能夠在粘附細(xì)胞和懸浮細(xì)胞中遞送mRNA。在HeLa細(xì)胞上進(jìn)行的初步轉(zhuǎn)染實(shí)驗(yàn)表明轉(zhuǎn)染緩沖液和載體濃度的重要性,而該技術(shù)進(jìn)一步證明可在Jurkat T細(xì)胞中有效遞送mRNA,轉(zhuǎn)染效率高達(dá)45%。重要的是,與電穿孔相比,電穿孔是T細(xì)胞非病毒轉(zhuǎn)染的參考技術(shù),轉(zhuǎn)染的活Jurkat T細(xì)胞數(shù)量增加了五倍。總而言之研究結(jié)果表明,將VNB光穿孔技術(shù)作為一種更溫和有效的技術(shù)用于粘附細(xì)胞和懸浮細(xì)胞的細(xì)胞內(nèi)mRNA傳遞,具有在治療和基礎(chǔ)研究應(yīng)用中未來改造細(xì)胞的潛力。
圖文導(dǎo)讀
VNB光孔法轉(zhuǎn)染mRNA
研究了用60 nm陽(yáng)離子PDDAC包被的AuNPs作為光熱納米粒進(jìn)行VNB光穿孔的適用性。直徑為60 nm的AuNPs被認(rèn)為是理想的光熱敏化劑,需要最小的氣泡成核閾值激光注量。對(duì)于VNB光孔法轉(zhuǎn)染,首先用陽(yáng)離子AuNPs孵育細(xì)胞。在沖洗掉未結(jié)合的AuNPs后,用單個(gè)激光脈沖7 ns照射會(huì)導(dǎo)致細(xì)胞結(jié)合的AuNPs產(chǎn)生VNBs。當(dāng)熱能被消耗時(shí),VNBs不可避免地崩塌,導(dǎo)致細(xì)胞膜上的局部孔隙形成,使細(xì)胞外mRNA分子通過這些膜孔直接擴(kuò)散到細(xì)胞質(zhì)中。
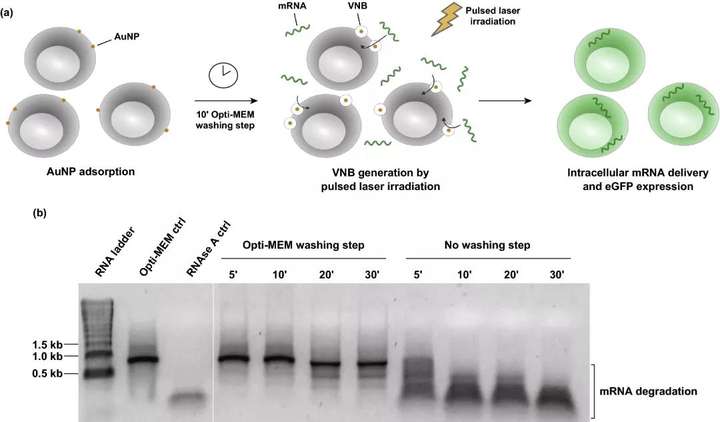
圖1. 氣相納米泡(VNB)光孔法轉(zhuǎn)染mRNA的優(yōu)化方法。(a) VNB光孔法轉(zhuǎn)染mRNA的示意圖。(b) 用天然瓊脂糖凝膠電泳分析物理mRNA的完整性;1 μg eGFP mRNA 孵育HeLa細(xì)胞上特定的時(shí)間,事先用/不用Opti-MEM洗滌。作為對(duì)照,mRNA只在Opti-MEM Opti-MEM-ctrl中培養(yǎng)或用10 μg mL RNAse A RNAse A ctrl孵育30分鐘。
II VNB光孔法在貼壁細(xì)胞中轉(zhuǎn)染mRNA
HeLa細(xì)胞系在這里作為初始優(yōu)化的參考細(xì)胞類型,因?yàn)樗呀?jīng)被廣泛用于通過VNB光孔作用來量化細(xì)胞內(nèi)各種分子(siRNA和納米抗體)的傳遞。優(yōu)化了VNB光孔法的相關(guān)參數(shù),包括AuNP濃度、激光能量、轉(zhuǎn)染緩沖液和mRNA濃度,以達(dá)到最大的轉(zhuǎn)染效率和可接受的細(xì)胞毒性。與絕大多數(shù)對(duì)粘附細(xì)胞系的科學(xué)研究相一致,HeLa細(xì)胞實(shí)驗(yàn)選擇了80%的細(xì)胞毒性閾值。
實(shí)驗(yàn)結(jié)果表明,細(xì)胞活力保持在80%以上的情況下,選擇8×10⁷ AuNPs mL ~5 AuNPs/細(xì)胞為最佳濃度,可產(chǎn)生約16%的eGFP陽(yáng)性細(xì)胞;在3.6 J cm的激光照射下,可產(chǎn)生高達(dá)20%的eGFP陽(yáng)性細(xì)胞;DPBS+作為HeLa細(xì)胞的轉(zhuǎn)染緩沖液時(shí),轉(zhuǎn)染效果最好;隨著mRNA濃度的增加,eGFP陽(yáng)性細(xì)胞的百分比增加,1.5 μM mRNA的eGFP陽(yáng)性細(xì)胞比例達(dá)到38%。
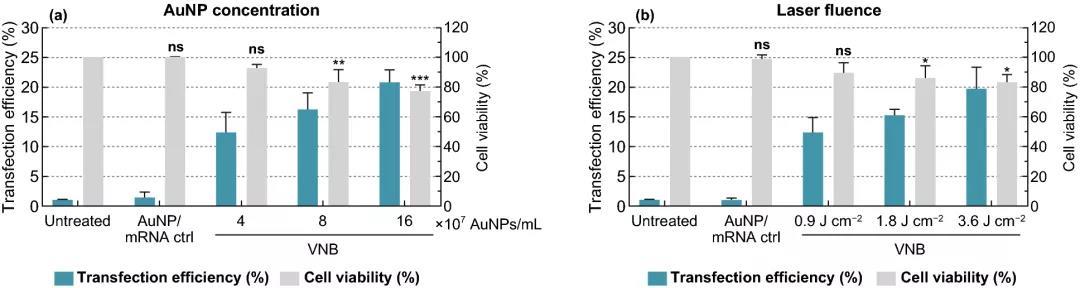
圖2. 金納米粒子AuNP濃度和激光照射量?jī)?yōu)化eGFP-mRNA轉(zhuǎn)染HeLa細(xì)胞。(a) 在0.3 μM-eGFP-mRNA存在下,使用1.8 J cm的固定激光能量,不同濃度的AuNP來光孔化HeLa細(xì)胞。(b) 在0.3 μM eGFP-mRNA存在下,使用8×107 AuNP mL的固定AuNP濃度,不同強(qiáng)度的激光能量來光孔化HeLa細(xì)胞。轉(zhuǎn)染效率用流式細(xì)胞術(shù)(n≥3)測(cè)定的eGFP陽(yáng)性細(xì)胞百分比表示。細(xì)胞活力值用CellTiter-Glo測(cè)定,并與未處理對(duì)照組(n=3)的相對(duì)值表示。采用單因素方差分析和Dunnett多重比較試驗(yàn)確定統(tǒng)計(jì)學(xué)差異(ns:無顯著差異;p<.05; p<.01; p<.001)。
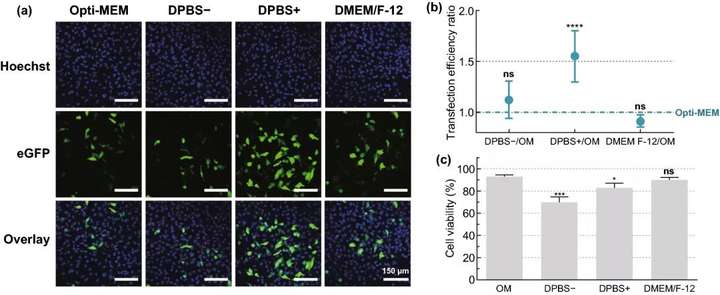
圖3. HeLa細(xì)胞mRNA轉(zhuǎn)染緩沖液的篩選。用不同的轉(zhuǎn)染緩沖液:Opti-MEM(OM)、DPBS-、DPBS+或DMEM/F-12,通過VNB光孔法(0.3 μM mRNA;8×107 AuNPs mL;3.6 J cm)轉(zhuǎn)染HeLa細(xì)胞。(a) 轉(zhuǎn)染后24小時(shí)HeLa細(xì)胞的典型共焦顯微鏡圖像(比例尺=150 μm)。(b) 用流式細(xì)胞術(shù)(n=6)測(cè)定不同緩沖液與OM的轉(zhuǎn)染效率比。進(jìn)行單因素方差分析和Dunnett多重比較試驗(yàn),以確定OM和其他緩沖液之間的統(tǒng)計(jì)差異(ns=無顯著性;****p<.0001)。(c) 轉(zhuǎn)染后24小時(shí)的細(xì)胞活力,與未經(jīng)處理的對(duì)照組相比(n=3)。進(jìn)行單因素方差分析和Dunnett多重比較試驗(yàn),以確定OM和其他緩沖液之間的統(tǒng)計(jì)差異(ns=無顯著性;p<.05;p<.001)。
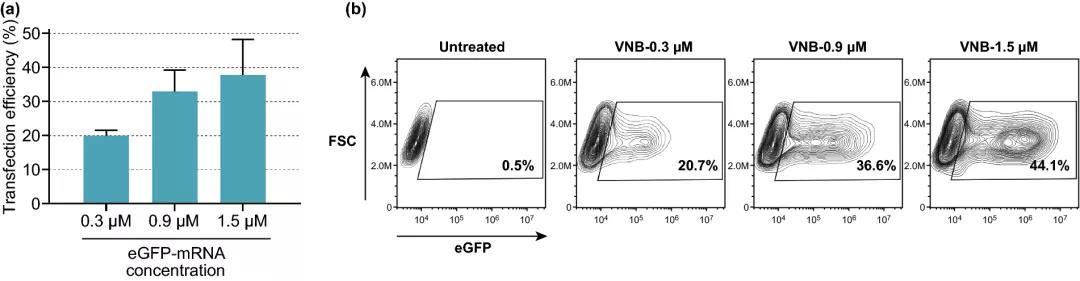
圖4. 提高eGFP-mRNA濃度對(duì)轉(zhuǎn)染效率的影響。(a) 不同濃度eGFP-mRNA的轉(zhuǎn)染效率,以eGFP陽(yáng)性細(xì)胞百分比表示(n=3)。(b) eGFP-mRNA轉(zhuǎn)染HeLa細(xì)胞典型實(shí)驗(yàn)的等高線圖。
III eGFP‑mRNA轉(zhuǎn)染Jurkat T細(xì)胞通過VNB光孔法
用Jurkat E6-1人白血病T細(xì)胞系作為原代人T細(xì)胞模型。與HeLa細(xì)胞轉(zhuǎn)染實(shí)驗(yàn)相似,首先對(duì)Jurkat細(xì)胞VNB光孔化過程中的不同關(guān)鍵參數(shù)進(jìn)行了優(yōu)化(圖5),即:(1)AuNP濃度;(2)激光注量;(3)轉(zhuǎn)染緩沖液。實(shí)驗(yàn)結(jié)果表明,4×10⁷AuNPs mL (~2 AuNPs/細(xì)胞)的濃度為最佳條件,在該條件下約13%的初始細(xì)胞群是可存活和轉(zhuǎn)染的;在0.9 J cm的最低激光能量下,活細(xì)胞和轉(zhuǎn)染細(xì)胞的產(chǎn)量最高(~14%);用OptiMEM作為轉(zhuǎn)染緩沖液,在Jurkat細(xì)胞上轉(zhuǎn)染效率最好。
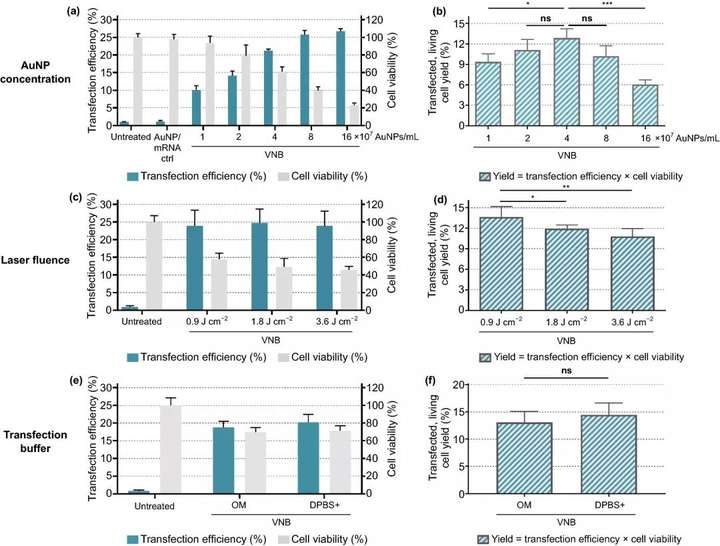
圖5. 金納米粒子(AuNP)濃度、激光能量和轉(zhuǎn)染緩沖液對(duì)eGFP-mRNA轉(zhuǎn)染Jurkat細(xì)胞的優(yōu)化。轉(zhuǎn)染效率表示eGFP陽(yáng)性細(xì)胞的百分比,細(xì)胞活力值是相對(duì)于未經(jīng)處理的對(duì)照組計(jì)算的,產(chǎn)量是轉(zhuǎn)染效率和細(xì)胞活力的乘積。(a, b) 使用1.8 J cm的固定激光注量篩選AuNP濃度(n=3,用Dunnett的多重比較試驗(yàn)進(jìn)行單向方差分析,ns=無顯著性;p<.05,***p<.001)。(c, d) 使用4×10⁷AuNP mL⁻1的固定AuNP濃度篩選激光能量(單位:J cm)(n=3,采用Dunnett多重比較試驗(yàn)的單向方差分析,ns=無意義;p<.05,p<.01)。e, f 比較Opti-MEM(OM)和DPBS+作為轉(zhuǎn)染緩沖液的轉(zhuǎn)染效率,使用4×10 AuNPs mL的固定AuNP濃度和0.9 J cm的激光能量(n=3,未配對(duì)的Student T檢驗(yàn),ns=不顯著)
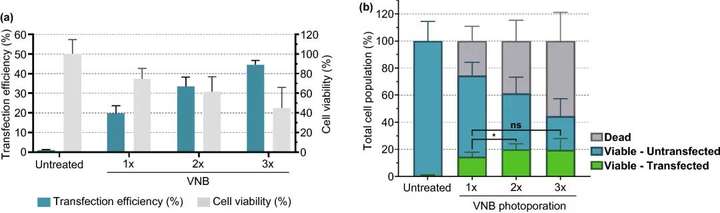
圖6. 連續(xù)多次VNB光孔處理對(duì)Jurkat細(xì)胞mRNA轉(zhuǎn)染效率的影響。(a) 轉(zhuǎn)染效率代表eGFP陽(yáng)性細(xì)胞的百分比,細(xì)胞活力值是相對(duì)于未經(jīng)處理的對(duì)照組計(jì)算的。(b) 計(jì)算不同條件下的活細(xì)胞/轉(zhuǎn)染細(xì)胞、活細(xì)胞/未轉(zhuǎn)染細(xì)胞和死亡細(xì)胞的數(shù)量n≥3,單因素方差分析與Tukey的多重比較試驗(yàn),p<0.05,ns=無顯著性。
IV VNB光穿孔比核型感染產(chǎn)生更多活的mRNA轉(zhuǎn)染Jurkat細(xì)胞
電穿孔是目前最常用的非病毒核酸轉(zhuǎn)染和T細(xì)胞體外修飾技術(shù),將我們的技術(shù)與商業(yè)的電穿孔系統(tǒng)進(jìn)行比較,結(jié)果顯示轉(zhuǎn)染的活Jurkat T細(xì)胞數(shù)量增加了五倍。
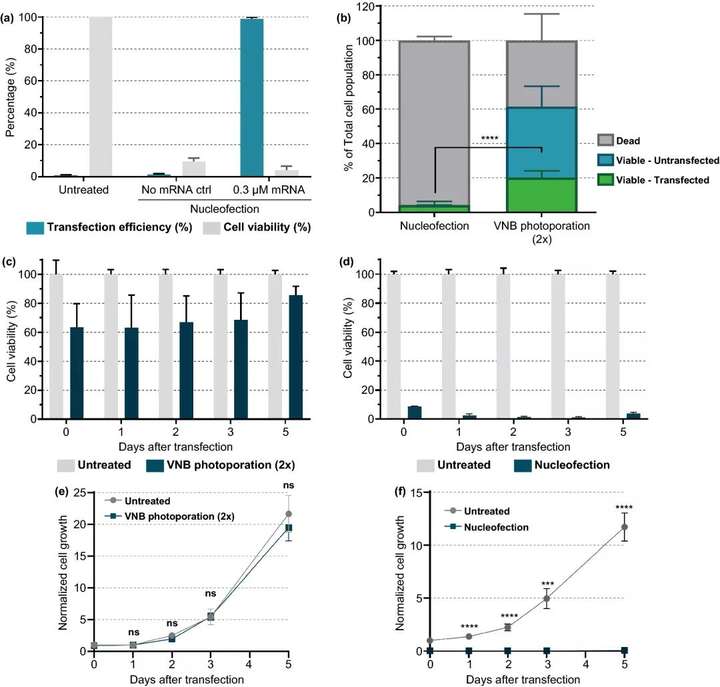
圖7. 核型感染和VNB光孔法mRNA轉(zhuǎn)染Jurkat細(xì)胞的比較。(a) 根據(jù)制造商的說明,通過核感染將eGFPmRNA (0.3 μM)轉(zhuǎn)染Jurkat細(xì)胞。轉(zhuǎn)染后24 h(n=3)用CellTiter-Glo法測(cè)定轉(zhuǎn)染效率(即eGFP陽(yáng)性細(xì)胞百分比)和細(xì)胞活力。(b) 核型感染和VNB光孔法在活細(xì)胞、轉(zhuǎn)染細(xì)胞產(chǎn)量方面的比較(n≥3,未配對(duì)Student T檢驗(yàn);****p<0.0001)。(c, d) 轉(zhuǎn)染后5天,在不同時(shí)間點(diǎn)測(cè)定VNB光孔(c) 或核感染(d) 后的細(xì)胞活力。第0天,在轉(zhuǎn)染后2h測(cè)定細(xì)胞活力。每天計(jì)算與未處理對(duì)照組相比的細(xì)胞活力值(n=2×3)。(e, f) 在轉(zhuǎn)染后5天,在不同時(shí)間點(diǎn)測(cè)量VNB光孔(e) 或核感染(f) 后的正常細(xì)胞生長(zhǎng)。在第0天計(jì)算與未處理對(duì)照組相比的標(biāo)準(zhǔn)化細(xì)胞生長(zhǎng)值。數(shù)據(jù)表示為平均值±SEM(n=2×3,未配對(duì)Students t test T;ns=無顯著性,p<0.001,p<0.0001。
本信息源自互聯(lián)網(wǎng)僅供學(xué)術(shù)交流 如有侵權(quán)請(qǐng)聯(lián)系我們立即刪除
| 溫馨提示:蘇州北科納米供應(yīng)產(chǎn)品僅用于科研,不能用于人體,不同批次產(chǎn)品規(guī)格性能有差異。網(wǎng)站部分文獻(xiàn)案例圖片源自互聯(lián)網(wǎng),圖片僅供參考,請(qǐng)以實(shí)物為主,如有侵權(quán)請(qǐng)聯(lián)系我們立即刪除。 |


