負載胰島素的膠束復合可注射水凝膠用于糖尿病傷口修復
發布時間:2021-02-20 09:09:49 人氣:1614
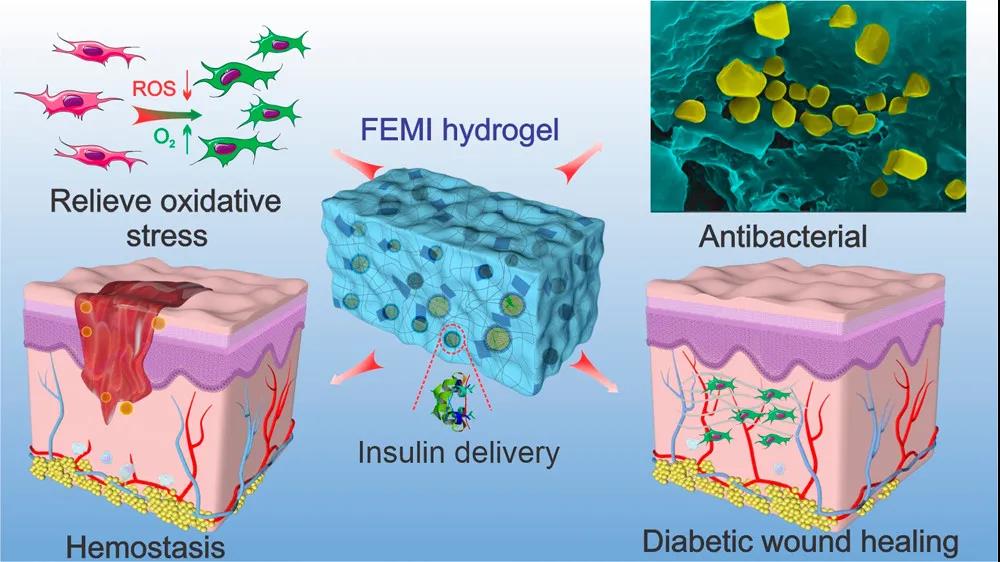
由于易受耐藥性細菌感染,糖尿病傷口愈合十分困難。目前相關研究領域已經出現了包括金屬和碳納米材料(金,氧化銅,氧化鋅,碳納米管和石墨烯)在內的多種抗菌劑作為抗生素替代品。但這些納米材料因無法生物降解或細胞相容性較差而應用受限。除細菌感染外,高血糖和氧化性微環境進一步阻礙了糖尿病皮膚傷口的恢復。在糖尿病條件下,包括中性粒細胞在內的免疫細胞會產生更多的活性氧(ROS),進而導致瘢痕形成時間延長或傷口無法愈合。
為了應對糖尿病傷口的細菌感染、高氧化及高血糖問題,來自西北工業大學的張秋禹教授團隊開發出一種基于醛基化改性F127膠束/聚賴氨酸包被二氧化錳的可注射水凝膠(FEM水凝膠)。該水凝膠體系中聚賴氨酸具有抗菌性,二氧化錳的還原性用于中和氧化性物質,F127可以包載胰島素用于降低血糖。相關研究論文:Nanoenzyme-Reinforced Injectable Hydrogel for Healing Diabetic Wounds Infected with Multidrug Resistant Bacteria發表于雜志Nano Letters上。
1. 水凝膠體系的構建研究人員對F127分子進行醛基化改性,使其形成的膠束表面富含醛基,該富含醛基的膠束與富含氨基的聚賴氨酸可通過席夫堿固化交聯,同時F127可熱致凝膠化,此雙重凝膠特性使其具備良好的可注射能力。將降血糖藥物胰島素包載于F127膠束疏水內核,同時利用聚賴氨酸包被二氧化錳,由此可得到具有抗菌、抗氧化、降血糖的水凝敷料。因聚賴氨酸具有細胞粘附特性,該水凝膠能很好支持細胞生長,有利于傷口組織愈合。(圖2)
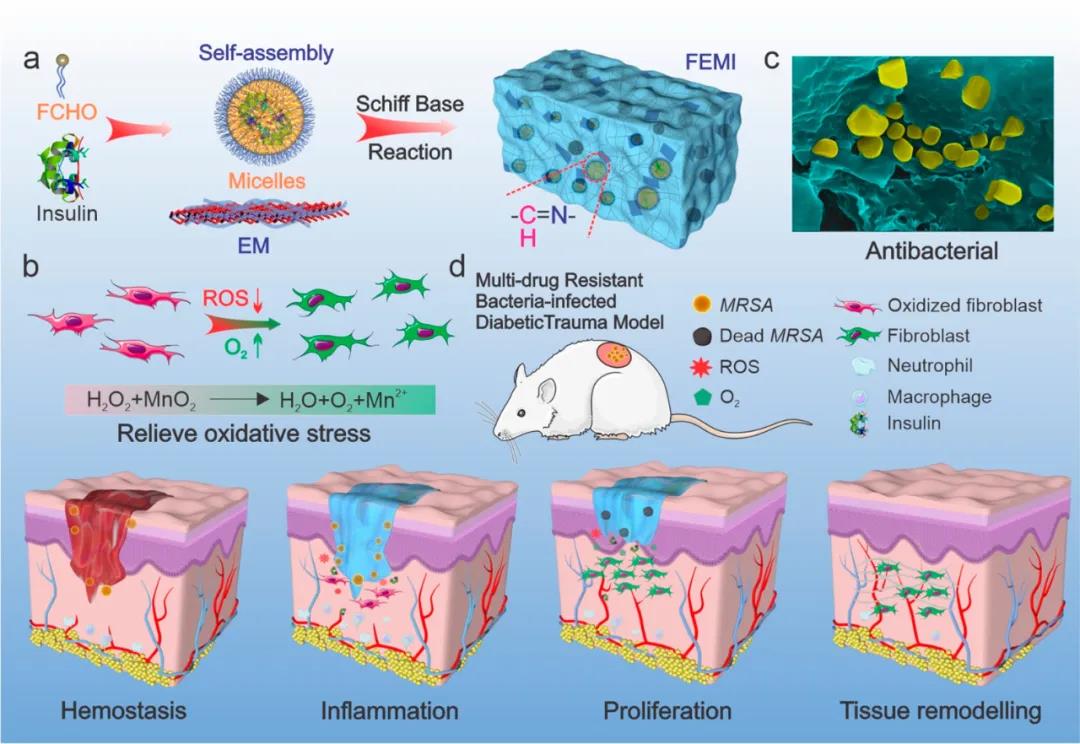
圖2 FEM水凝膠制備示意圖
2. FEM敷料具有持續抗菌及消除自由基能力糖尿病患者中升高的葡萄糖參與了ROS的大量產生,這阻礙了傷口的愈合。二氧化錳的加入可有效消除ROS并補充氧氣。與雙氧水對照組相比,與FEM-4水凝膠共孵育的成纖維細胞顯示出顯著更低的綠色熒光,這表明FEM水凝膠可以有效減輕細胞內的氧化應激。(圖3e)研究人員對FEM水凝膠的胰島素釋放行為進行了研究(圖3 ⅰ)。與對照組相比,在酸性和氧化性條件下,前6小時內胰島素快速釋放,顯示出獨特的pH /氧化還原雙重響應性。
此外,研究了FEM水凝膠和不同成分的細胞毒性。在孵育24和48小時后,成纖維細胞和成肌細胞均顯示出高細胞活力。
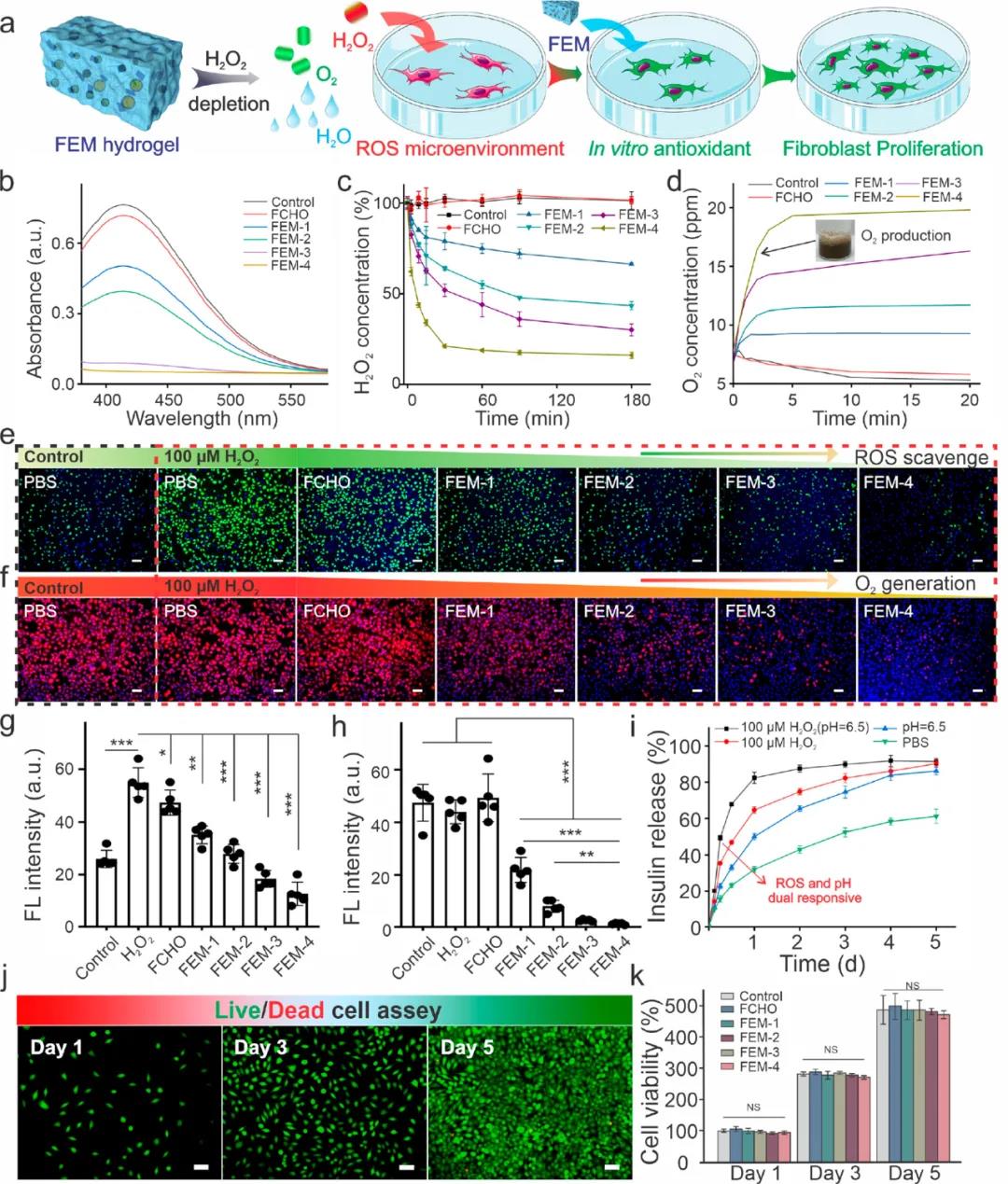
圖3 FEM水凝膠抗氧化性、胰島素釋及生物相容性測試
3. FEM水凝膠的抗菌性能FEM水凝膠的抗菌行為的體外評價結果表明:與PBS和抗生素氨芐西林相比,FEM水凝膠對金黃色葡萄球菌,大腸桿菌和MRSA表現出更優異的抗菌能力。此外,隨著FEM水凝膠中包被二氧化錳片含量的增加,抗菌作用顯著增強,其中FEM-4組表現出最出色的抗菌能力,細菌菌落幾乎減少了100%(圖4 a)。使用小鼠出血性肝模型評估了FEM水凝膠的止血能力(圖4 d)。與空白對照組相比,FEM組的失血量顯著減少(圖4e,f)。FEM水凝膠的快速止血性能可能歸因于較短的膠凝時間和強的組織粘合性。此外,水凝膠表面的帶正電荷的氨基還可以通過靜電相互作用與血細胞緊密結合,從而吸收細胞,激活血凝塊的形成。
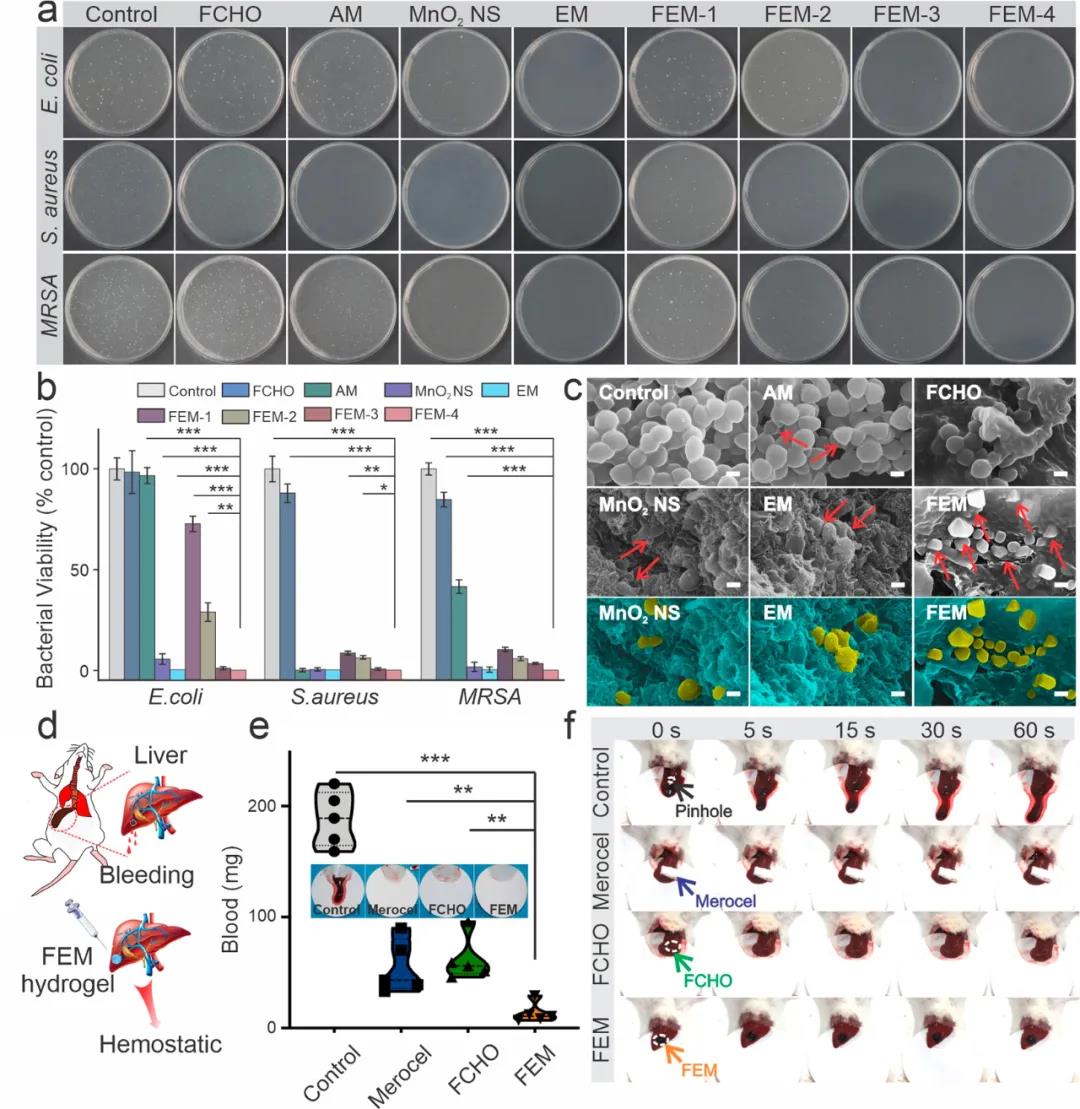
圖4 FEM水凝膠的抗菌和止血性能評價
4. GelTA-Alla敷料的傷口模型評價將水凝膠直接注射到小鼠背部產生的傷口中。與第3天的對照組相比,FEM和FEMI(負載胰島素)水凝膠組均顯示出最有效的殺菌作用。在持續的傷口愈合實驗中,用FEM和FEMI處理的小鼠的傷口顯示出明顯加速的傷口閉合。敷有FEMI水凝膠的傷口在第14天愈合得最好(剩余11.70%),基本上被新形成的皮膚覆蓋(圖5b–d)。
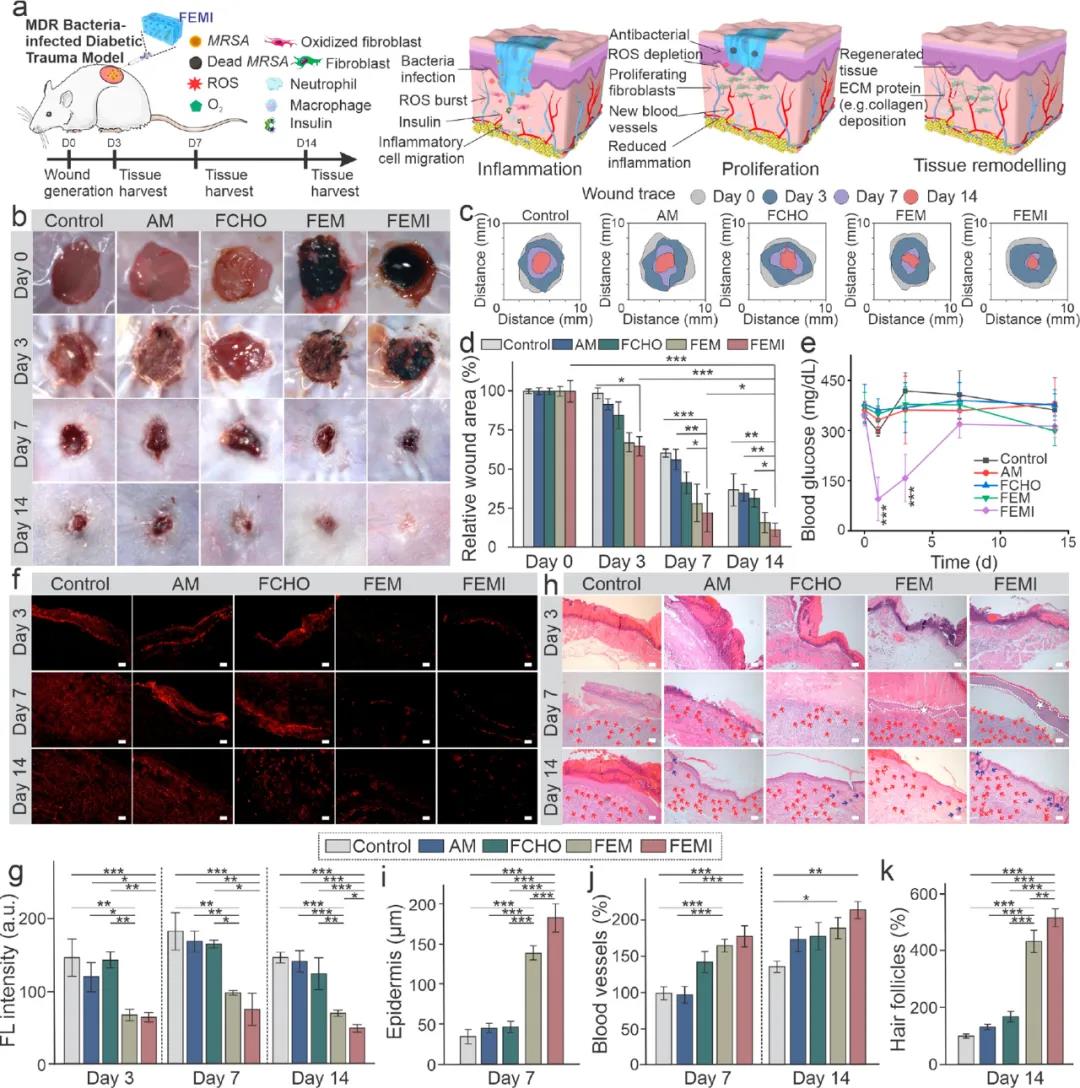
圖5 FEM水凝膠的糖料病傷口動物模型評價
該研究設計了一種抗氧化、抗菌和降血糖的可注射水凝膠敷料,并驗證了其可有效促進細菌感染糖尿病傷口的愈合。該水凝膠敷料還可協同減少炎癥反應、刺激血管生成、加速細胞增殖、促進肉芽組織形成和ECM沉積,在體內加速糖尿病皮膚重建方面顯示出巨大潛力。| 溫馨提示:蘇州北科納米供應產品僅用于科研,不能用于人體,不同批次產品規格性能有差異。網站部分文獻案例圖片源自互聯網,圖片僅供參考,請以實物為主,如有侵權請聯系我們立即刪除。 |
下一篇: 納米醫學產品1


